|
ФЕРМЕНТЫ (от лат.
fermentum - закваска) (энзимы), белки, выполняющие роль катализаторов в живых
организмах. Осн. ф-ции Ф.- ускорять превращение в-в, поступающих в организм
и образующихся при метаболизме (для обновления клеточных структур, для обеспечения
его энергией и др.), а также регулировать биохим. процессы (напр., реализацию
ге-нетич. информации), в т. ч. в ответ на изменяющиеся условия.
О механизме р-ций с участием
Ф. (ферментативных р-циях) см. Ферментативный катализ, Ферментативных реакций
кинетика.
Структуру Ф. изучают методами
хим. модификации, рентгеновского структурного анализа, спектроскопии. Ценные
результаты получены методом сайт-специфичного мутагенеза, основанного на направленной
замене аминокислот в белковой молекуле методами генетической инженерии. К
кон. 20 в. известно и охарактеризовано ок. 3000 Ф.
Исторический очерк.
Начало совр. науки о Ф. (энзимоло-гии) связывают с открытием в 1814 К. Кирхгофом
превращения крахмала в сахар под действием водных вытяжек из проростков ячменя.
Действующее начало из этих вытяжек было выделено в 1833 А. Пайеном и Ж. Персо.
Им оказался Ф. амилаза. В 1836 T. Шванн обнаружил и описал пепсин,
в том же году И. Пуркин и И. Паппенгейм охарактеризовали трипсин. В
1897 братья Г. и Э. Бухнеры выделили из дрожжей р-римый препарат (т. наз. зимазу),
вызывавший спиртовое брожение. Этим был положен конец спору Л. Пастера (он полагал,
что процесс брожения могут вызывать только целостные живые клетки) и Ю. Либиха
(считал, что брожение связано с особыми в-вами). В кон. 19 в. Э. Фишер предложил
первую теорию специфичности Ф. В 1913 Л. Михаэлис сформулировал общую теорию
кинетики ферментативных р-ций. В кристаллич. виде первые Ф. были получены Дж.
Самнером в 1926 (уреаза) и Дж. Нортропом в 1930 (пепсин). Впервые первичная
структура (аминокислотная последовательность) Ф. была установлена У. Стейном
и С. Муром в 1960 для рибонуклеазы А, а в 1969 P. Меррифилдом осуществлен хим.
синтез этого Ф. Пространственное строение (третичная структура) Ф. впервые установлено
Д. Филлипсом в 1965 для лизоцима. Во 2-й пол. 20 в. каталитич. активность была
открыта также у нек-рых РНК (их наз. рибозимы).
Классификация ферментов.
Исторически многим Ф. присваивались тривиальные названия, часто не связанные
с типом катализируемой р-ции. Для преодоления возникших трудностей в сер. 20
в. были разработаны классификации и номенклатура Ф. По рекомендации Международного
биохим. союза, все Ф. в зависимости от типа катализируемой р-ции делят на 6
классов: 1-й - оксидоредуктазы, 2-й - трансферазы, 3-й - гидролазы,
4-й - лиазы, 5-й - изомеразы и 6-й - лигазы. Каждый
класс делится на подклассы, в соответствии с природой функц. групп субстратов,
подвергающихся хим. превращению. Подклассы, в свою очередь, делятся на подпод-классы
в зависимости от типа участвующего в превращении Ф. Каждому достаточно охарактеризованному
Ф. присваивается классификационный номер из 4 цифр, обозначающих класс, подкласс,
подподкласс и номер самого Ф. Напр., a-химотрипсин имеет номер 3.4.21.1.
К оксидоредуктазам относятся
F., катализирующие окислит.-восстановит. р-ции. Ф. этого типа переносят
атомы H или электроны.
Многие оксидоредуктазы являются Ф. дыхания и окислительного фосфорилирования.
Трансферазы катализируют
перенос функц. групп (CH3, COOH, NH2, CHO и др.) от одной
молекулы к другой.
Гидролазы катализируют
гидролитич. расщепление связей (пептидной, гликозидной, эфирной, фосфодиэфирной
и др·)·
Л и а з ы катализируют
негидролитич. отщепление групп от субстрата с образованием двойной связи и обратные
р-ции. Эти Ф. могут отщеплять CO2, H2O, NH3
и др.
Изомеразы катализируют
образование изомеров субстрата, в т. ч. цис-, транс-изомеризацию, перемещение
кратных связей, а также групп атомов внутри молекулы.
Л и г а з ы - Ф., катализирующие
присоединение двух молекул с образованием новых связей (С — С, С — S, С — О,
С — N и др.), как правило, сопряженное с расщеплением пирофос-фатной связи,
напр. у АТФ.
Особенности строения
ферментов. Мол. масса Ф. составляет от 104 до 1010 и
более. Чаще всего встречаются Ф. с мол. м. 20-60 тыс., более крупные обычно
состоят из неск. одинаковых (гомомеры) или разных (гетеромеры) субьеди-ниц,
связанных между собой нековалентными связями. Субъединица может состоять из
двух и более цепей, соединенных дисульфидными связями.
В первичной структуре однотипных
Ф., выделенных даже из эволюционно отдаленных организмов, часто наблюдается
определенная гомология, а нек-рые участки практически остаются неизменными.
Вторичная структура отличается большим разнообразием по содержанию 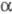 -спиралей
и -спиралей
и 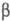 -структур
(см. Белки). -структур
(см. Белки). 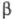 -Структуры
составляют ядро многих Ф., образуя "опорную" структуру. Совокупность
стандартных элементов вторичных структур и специфически уложенных участков полипептидной
цепи, определенным образом расположенных в пространстве, образует третичную
структуру, определяющую биол. св-ва Ф. -Структуры
составляют ядро многих Ф., образуя "опорную" структуру. Совокупность
стандартных элементов вторичных структур и специфически уложенных участков полипептидной
цепи, определенным образом расположенных в пространстве, образует третичную
структуру, определяющую биол. св-ва Ф.
Третичная структура уникальна
для каждого Ф., однако у однотипных Ф., даже сильно отличающихся по первичной
структуре, пространственное расположение цепей м. б. сходным (напр., химотрипсины
и субтилизины). Часто в третичной структуре можно выделить отдельные компактные
части (домены), соединенные участками полипептидной цепи. Организация в пространстве
неск. субъединиц определяет четвертичную структуру Ф.
На пов-сти белковой глобулы
Ф. или, чаще, в спец. щели, углублении и т. п. выделяют относительно небольшой
участок, наз. активным центром. Он представляет собой совокупность функц. групп
аминокислотных остатков, непосредственно взаимодействующих с субстратом. В активный
центр Ф., кроме функц. групп, могут входить небелковые составляющие - коферменты.
Такой комплекс наз. х о л о -ферментом, а его белковую часть - апоферментом.
Аминокислотные остатки, входящие в активный центр, относятся к наиб. консервативным
в данной группе Ф. В активном центре можно выделить субстрат-связывающий участок
и собственно каталитически активные группы Ф. К последним, напр., в подподклассе
сериновых протеаз относятся функц. группы остатков серина-195, гистидина-57
и аспарагиновой к-ты-102. Кроме того, в качестве каталитически активных групп
Ф. выступают группа SH цистеина, группа COOH глугаминовой к-ты, фенольный гидроксил
тирозина и др., а также функц. группы коферментов - никотинамидное кольцо никотинамидных
коферментов (см. Ниацин), альдегидная группа (в виде альдимина) пиридоксальфосфата,
тиазолино-вое кольцо тиаминпирофосфата, ионы металлов (напр., Zn2+,
Co2+, Mn2+) и др.
Получение ферментов.
Обычно Ф. вьщеляют из тканей животных, растений, клеток и культуральных
жидкостей микроорганизмов, биол. жидкостей (кровь, лимфа и др.). Для получения
нек-рых труднодоступных Ф. используются методы генетической инженерии. Из исходных
материалов Ф. экстрагируют солевыми р-рами. Затем их разделяют на фракции, осаждая
солями [обычно (NH4)2SO4] или, реже, орг. р-рителями,
и очищают методами гель-проникающей и ионо-обменной
хроматографии. На заключит. этапах очистки часто используют методы аффинной
хроматографии. Контроль за ходом очистки Ф. и характеристику чистых препаратов
осуществляют, измеряя каталитич. активность Ф. с применением специфических (обычно
дающих цветные р-ции) субстратов. За единицу кол-ва Ф. принимают такое его кол-во,
к-рое катализирует превращение 1 мкмоля субстрата в 1 мин в стандартных условиях.
Число единиц Ф., отнесенное к 1 мг белка, наз. удельной активностью.
Применение ферментов.
В неочищенном состоянии Ф. с древнейших времен используют для получения
продуктов питания и выделки изделий в хлебопечении, сыроделии, виноделии, обработке
кож и т. д. Достаточно очищенные Ф. применяют в произ-ве аминокислот и их смесей
для искусственного питания, в произ-ве сахарных сиропов из углеводсо-держащего
сырья, для удаления лактозы из молока и в произ-ве ряда лек. ср-в (нек-рые очищенные
Ф. сами используются как лек. ср-ва). Особенно перспективно применение в пром-сти
иммобилизованных ферментов на полимерных носителях (напр., для получения
полусинтетич. пеницилли-нов применяют иммобилизованную пенициллинамидазу, см.
также Ферментсодержащие волокна). Об использовании Ф. в хим. анализе
см. Ферментативные методы анализа.
===
Исп. литература для статьи «ФЕРМЕНТЫ»: Номенклатура
ферментов (Рекомендации 1972), пер. с англ., M., 1979; Фершт Э., Структура и
механизм действия ферментов, пер. с англ., M., 1980; Диксон M., Уэбб Э., Ферменты,
пер. с англ., т. 1-3, M., 1982; Methods in enzymology, eds. S. P. Colowick,
N. O. Kaplan, N. Y.- S. F.- L., 1955.
В. К. Антонов.
Страница «ФЕРМЕНТЫ» подготовлена по материалам химической энциклопедии.
|

