|
ТРИПТОФАНA3А
(триптофан-индол-лиаза), фермент класса лиаз, катализирующий расщепление триптофана:
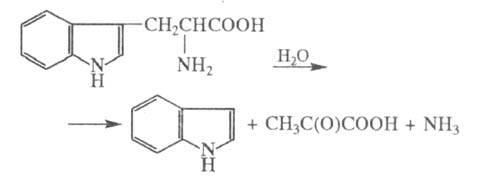
Катализирует также расщепление
по такой же схеме др. b-замещенных 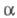 -L-аминокислот
[напр., цистеин, серин, CH3SCH2CH(NH2)COOH];
обратную р-цию - синтез триптофана [при избытке NH3 и CH3C(O)COOH];
замещение индо-лильного остатка в триптофане (в т.ч. если в цикле есть заместители)
на C6H5S, CH3S, HS и RO при действии соотв.
C6H5SH, CH3SH, H2S и ROH; изотопный
обмен a-Н-атома на дейтерий у мн. -L-аминокислот
[напр., цистеин, серин, CH3SCH2CH(NH2)COOH];
обратную р-цию - синтез триптофана [при избытке NH3 и CH3C(O)COOH];
замещение индо-лильного остатка в триптофане (в т.ч. если в цикле есть заместители)
на C6H5S, CH3S, HS и RO при действии соотв.
C6H5SH, CH3SH, H2S и ROH; изотопный
обмен a-Н-атома на дейтерий у мн.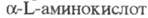
T. широко распространена
среди разл. видов бактерий. Наиб. изучена T. из штаммов В/1t7-А и К-12
Escherichia coli. Молекула T. содержит 4 идентичные субъединицы с мол. м. 54
тыс., состоящих из одной полипептидной цепи (ее первичная структура известна).
Каждая субъединица в активном центре связывает одну молекулу пиридоксальфосфата
(ПЛФ; см. Витамин B6). Активный комплекс T. с ПЛФ образуется
в присут. NH4+, К+ и Rb+ (Na+
ингибирует Т.). Оптим. каталитич. активность T. при рН 8,0-9,0; рI4,95.
В присуг. ионов K+
и NH+4 T. имеет 2 характерных рН-за-висимых максимума
в спектре поглощения в областях 337 и 420 нм, обусловленных альдиминной группой
(основание Шиффа), образованной альдегидной группой ПЛФ с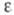 -аминогруппой
остатка лизина-270. В связывании ПЛФ принимают также участие остатки цистеина-298
и триптофана-330. -аминогруппой
остатка лизина-270. В связывании ПЛФ принимают также участие остатки цистеина-298
и триптофана-330.
Конкурентные, обратимые
ингибиторы Т.- нек-рые аминокислоты, напр. L-аланин.
===
Исп. литература для статьи «ТРИПТОФАНA3А»: Snell E. E.,
"Adv. Enzymol.", 1975, v. 42, r. 287-333; Miles E. W.,
Vitamin B6, pyridoxal phosphate, v. 1, pt B, N. Y., 1986, p. 253-310.
И. С. Дементьева.
Страница «ТРИПТОФАНA3А» подготовлена по материалам химической энциклопедии.
|

