|
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ,
теплота, выделенная или поглощенная термодинамич. системой при протекании в
ней хим. р-ции. Определяется при условии, что система не совершает никакой работы
(кроме возможной работы расширения), а т-ры реагентов и продуктов равны. Поскольку
теплота не является ф-цией состояния, т.е. при переходе между состояниями зависит
от пути перехода, то в общем случае Т. э. р. не может служить характеристикой
конкретной р-ции. В двух случаях бесконечно малое кол-во теплоты (элементарная
теплота) dQ совпадает с полным дифференциалом ф-ции состояния: при
постоянстве объема dQ = = dU (U-внутр. энергия системы),
а при постоянстве давления dQ = dH (H-энтальпия системы).
Практически важны два типа
Т. э. р.-изотермо-изобар-ный (при постоянных т-ре Т и давлении р)
и изотермо-изо-хорный (при постоянных Т и объеме V). Различают
дифференциальный и интегральный Т. э. р. Дифференциальный Т. э. р. определяется
выражениями:
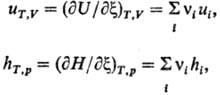
где ui,
hi-соотв. парциальные молярные внутр. энергия и энтальпия;
vi-стехиометрич. коэф. (vi > 0 для продуктов,
vi<0 для реагентов); x = (ni - ni0)/vi,-хим.
переменная, определяющая состав системы в любой момент протекания р-ции (ni
и ni0 - числа молей i-го компонента
в данный момент времени и в начале хим. превращения соотв.). Размерность дифференциального
Т. э. р.-кДж/моль. Если uT,V, hT,p > 0,
р-ция наз. эндотермической, при обратном знаке эффекта-экзотермической. Два
типа эффектов связаны соотношением:
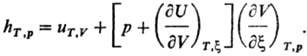
Для идеального газа (9U/9V)T,x
= 0 и учет ур-ния состояния pV = RT приводит к выражению:(R
- газовая постоянная).
Поэтому если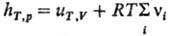 газофазная
р-ция протекает с изменением числа молей, то hT,p .
uT,V. Для конденсир. фаз в силу малости производной
(9V/9V)T,р разность hT,p
— uT,V мала и ею обычно пренебрегают. На практике обычно приходится
иметь дело с изобарич. условиями (р = = const), когда Т.
э. р. совпадает с изменением энтальпии системы. Поэтому вместо термина "Т.
э. р." используют термин "энтальпия р-ции". Тепловые эффекты
hT,p, uT,V в общем случае зависят от состава
системы, т. к. величины ui, hi изменяются
по мере протекания р-ции. газофазная
р-ция протекает с изменением числа молей, то hT,p .
uT,V. Для конденсир. фаз в силу малости производной
(9V/9V)T,р разность hT,p
— uT,V мала и ею обычно пренебрегают. На практике обычно приходится
иметь дело с изобарич. условиями (р = = const), когда Т.
э. р. совпадает с изменением энтальпии системы. Поэтому вместо термина "Т.
э. р." используют термин "энтальпия р-ции". Тепловые эффекты
hT,p, uT,V в общем случае зависят от состава
системы, т. к. величины ui, hi изменяются
по мере протекания р-ции.
Интегральный Т. э. р. в
расчете на один пробег р-ции (изменение числа молей в-ва равно его стехиометрич.
коэффициенту) измеряется в кДж и определяется ф-лами:
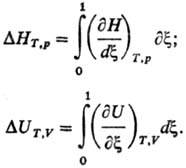
Если по условиям проведения
р-ции hi не зависят от состава (р-ции в неплотных газах, в
разб. р-рах), дифференциальный и интегральный Т. э. р. численно совпадают. В
противном случае отнесение измеренного Т. э. р. DHT,p
к изменению числа молей реагента или продукта дает средний Т. э. р. (кДж/моль).
Температурная зависимость
Т. э. р. дается Кирхгофа уравнением, применение к-рого, строго говоря,
требует знания парциальных молярных теплоемкостей всех участвующих в р-ции в-в,
однако в большинстве случаев эти величины неизвестны. Поскольку для р-цик, протекающих
в реальных р-рах и др. термодинамически неидеальных средах, Т. э. р., как и
др. парциальные молярные величины, существенно зависят от состава системы и
эксперим. условий, разработан подход, облегчающий сопоставление энергетики разных
р-ций и систематику Т. э. р. Этой цели служит понятие стандартного Т. э. р.
(обозначается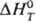 ).
Под стандартным понимается Т. э. р., осуществляемой (часто гипртетичес-ки) в
условиях, когда все участвующие в р-ции в-ва находятся
в заданных стандартных состояниях. Дифференц. и интегральный стандартные
Т. э. р. всегда численно совпадают. Стандартный Т.э. р. легко рассчитать с использованием
таблиц стандартных теплот образования или теплот сгорания в-в (см. ниже). Для
неидеальных сред между реально измеренными и стандартными Т.э.р. существует
большое расхождение, что необходимо иметь в виду при использовании Т.э.р. в
тврмодинамич. расчетах. Напр., для щелочного гидролиза диацетимида [(СН3СО)2
NH (тв) + Н2О(ж) = = СН3СОКН2(тв) + СН3СООН(ж)+ ).
Под стандартным понимается Т. э. р., осуществляемой (часто гипртетичес-ки) в
условиях, когда все участвующие в р-ции в-ва находятся
в заданных стандартных состояниях. Дифференц. и интегральный стандартные
Т. э. р. всегда численно совпадают. Стандартный Т.э. р. легко рассчитать с использованием
таблиц стандартных теплот образования или теплот сгорания в-в (см. ниже). Для
неидеальных сред между реально измеренными и стандартными Т.э.р. существует
большое расхождение, что необходимо иметь в виду при использовании Т.э.р. в
тврмодинамич. расчетах. Напр., для щелочного гидролиза диацетимида [(СН3СО)2
NH (тв) + Н2О(ж) = = СН3СОКН2(тв) + СН3СООН(ж)+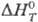 ]
в 0,8 н. р-ре NaOH в водном этаноле (58% по массе этанола) при 298 К измеренный
Т. э. p. DH1 = — 52,3 кДж/моль. Для той же р-ции в стандартных
условиях получено ]
в 0,8 н. р-ре NaOH в водном этаноле (58% по массе этанола) при 298 К измеренный
Т. э. p. DH1 = — 52,3 кДж/моль. Для той же р-ции в стандартных
условиях получено 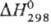 =
— 18,11 кДж/моль.
Столь значит. разница объясняется тепловыми эффектами, сопровождающими растворение
в-в в указанном р-рителе (теплотами растворения). Для твердого ацетамида, жидкой
уксусной к-ты и воды теплоты растворения равны соотв.: DH2
= 13,60; DH3 = - 48,62; DH4 =
- 0,83 кДж/моль, так что =
— 18,11 кДж/моль.
Столь значит. разница объясняется тепловыми эффектами, сопровождающими растворение
в-в в указанном р-рителе (теплотами растворения). Для твердого ацетамида, жидкой
уксусной к-ты и воды теплоты растворения равны соотв.: DH2
= 13,60; DH3 = - 48,62; DH4 =
- 0,83 кДж/моль, так что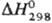 =
DH1 — DH2 - DH3
+ DH4. Из примера видно,
что при исследованиях Т.э.р. важны измерения тепловых эффектов сопутствующих
физ.-хим. процессов. =
DH1 — DH2 - DH3
+ DH4. Из примера видно,
что при исследованиях Т.э.р. важны измерения тепловых эффектов сопутствующих
физ.-хим. процессов.
Изучение Т. э. р. составляет
важнейшую задачу термохимии. Осн. эксперим. метод -калориметрия. Совр.
аппаратура позволяет изучать Т.э.р. в газовой, жидкой и твердой фазах, на границе
раздела фаз, а также в сложных биол. системах. Диапазон типичных значений измеряемых
Т.э.р. составляет от сотен Дж/моль до сотен кДж/моль. В табл. приводятся данные
калориметрич. измерений Т. э. р. нек-рых р-ций. Измерение тепловых эффектов
смешения, растворения, разведения, а также теплот фазовых переходов позволяет
перейти от реально измеренных Т. э. р. к стандартным.

Важная роль принадлежит
Т.э. р. двух типов-теп лотам образования соед. из простых в-в и теплотам сгорания
в-в в чистом кислороде с образованием высших оксидов элементов, из к-рых состоит
в-во. Эти Т. э. р. приводятся к стандартным условиям и табулируются. С их помощью
легко рассчитать любой Т. э. р.; он равен алгебраич. сумме теплот образования
или теплот сгорания всех участвующих в р-ции в-в:
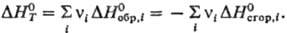
Применение табличных величин
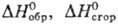 позволяет вычислять
тепловые эффекты мн. тысяч р-ций, хотя сами эти величины известны лишь для неск.
тыс. соединений. Такой метод расчета непригоден, однако, для р-ций с небольшими
тепловыми эффектами, т. к. расчетная малая величина, полученная как алгебраич.
сумма неск. больших величин, характеризуется погрешностью, к-рая по абс. величине
может превосходить Т.э.р. Расчет Т.э.р. с помощью величин позволяет вычислять
тепловые эффекты мн. тысяч р-ций, хотя сами эти величины известны лишь для неск.
тыс. соединений. Такой метод расчета непригоден, однако, для р-ций с небольшими
тепловыми эффектами, т. к. расчетная малая величина, полученная как алгебраич.
сумма неск. больших величин, характеризуется погрешностью, к-рая по абс. величине
может превосходить Т.э.р. Расчет Т.э.р. с помощью величин 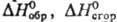 основан на том, что энтальпия есть ф-ция состояния. Это позволяет составлять
системы термохим. ур-ний для определения теплового эффекта требуемой р-ции (см.
Гесса закон). Вычисляют практически всегда стандартные Т.э.р.
Помимо рассмотренного выше метода расчет Т.э.р. проводят по температурной зависимости
константы равновесия -ур-ния изобары и изохоры р-ции (см. Константа
равновесия)с помощью ф-лы:
основан на том, что энтальпия есть ф-ция состояния. Это позволяет составлять
системы термохим. ур-ний для определения теплового эффекта требуемой р-ции (см.
Гесса закон). Вычисляют практически всегда стандартные Т.э.р.
Помимо рассмотренного выше метода расчет Т.э.р. проводят по температурной зависимости
константы равновесия -ур-ния изобары и изохоры р-ции (см. Константа
равновесия)с помощью ф-лы: 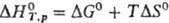 ,
где DG0
= RТ ln К-стандартная энергия Гиббса р-ции, К -константа
равновесия, a DS0-стандартная энтропия р-ции, вычисляемая
по стандартным энтропиям всех в-в, участвующих в р-ции. ,
где DG0
= RТ ln К-стандартная энергия Гиббса р-ции, К -константа
равновесия, a DS0-стандартная энтропия р-ции, вычисляемая
по стандартным энтропиям всех в-в, участвующих в р-ции.
Значение исследований Т.э.р.
в химии очень велико. Знание Т. э. р. необходимо для расчетов тепловых балансов
технол. процессов. Теплоты сгорания применяют при подборе оптим. топлив, расчетах
уд. тяги ракетных двигателей, оценке калорийности продуктов. В практич. термодинамике
Т. э. р. используют для расчета температурной зависимости констант равновесия,
энтропийных эффектов хим. р-ций, при исследованиях кислотно-основных взаимодействий.
Так, параметр полярности р-рителей (донорное число по Гутману), есть Т.э.р.
р-рителя со стандартной льюисовской к-той SbCl5. С помощью Т. э.
р. определяют энергии хим. связей, рассчитывают термодинамич. ф-ции образования
молекул и ионов в конкретных состояниях. Широко применяют Т.э.р. также в корреляционных
соотношениях.
===
Исп. литература для статьи «ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ»: Мортимер К.,
Теплоты реакций и прочность связей, пер. с англ., М., 1964; Пригожин И., Дефэй
Р., Химическая термодинамика, пер. с англ., Новосиб., 1966; Термические константы
веществ. Справочник, под ред. В.П.Глушко, в. 1-10, 1965-82. См. также лит. при
статьях Калориметрия, Термохимия. М. Ю. Панов.
Страница «ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ» подготовлена по материалам химической энциклопедии.
|

