|
ТАНТАЛ (по имени
героя др.-греч. мифологии Тантала, осужденного на вечную неутолимую жажду; назван
так из-за трудности получения его в чистом виде; лат. Tantalum)Ta, хим. элемент
V гр. периодич. системы, ат. н. 73, ат. м. 180,9479. В природе два изотопа:
стаб. 181Та (99,9877%) и радиоактивный 180Та (0,0123%,
b-излучатели, Т1/2 1·1013 лет). Поперечное
сечение захвата тепловых нейтронов 2,13·10-27 м2. Конфигурация
внеш. электронных оболочек атома 5s25р65d36s2;
степень окисления +5, значительно реже + 4, +3 и +2; энергии ионизации Та0
: Та+ : Та2+ соотв. 7,89 и 16,2 эВ;
электроотрицательность по Полингу 1,5; атомный радиус 0,146 нм, ионные радиусы,
нм (в скобках указаны координац. числа): Та3+ 0,086(6), Та4+
0,082(6), Та5+ 0,078 (6), 0,083 (7), 0,088(8).
Содержание Т. в земной
коре 2,5·10-4% по массе. Встречается в природе обычно вместе с Nb.
Входит в состав неск. десятков минералов, представляющих собой тантало-нио-баты
или титано-тантало-ниобаты. Важнейшие из них-колумбит-танталит и пирохлор (см.
Ниобии), микролит-разновидность пирохлора с содержанием 55-74%
Та2О5. Т. содержится также в касситерите (см. Олово),
при переработке к-рого Т. переходит в шлаки восстановит. плавки (11-15%,
иногда до 30% Та2О5). Месторождения Т. имеются в Нигерии,
Канаде, Бразилии, СНГ, Австралии, Заире, Малайзии, Мозамбике и Таиланде. Общие
мировые запасы Т. в 1980 оценивались в 254 тыс. т, в пром. месторождениях-ок.
65, 3 тыс. т.
Свойства. Т.-блестящий
серебристо-серый металл; кри-сталлич. решетка кубическая объемноцентрированная,
а = 0,3296 нм, z = 2, пространств. группа Iт3т. Т.
пл. 3014°С, т. кип. ок. 5500°С; плотн. 16,60 г/см3 (20°С);
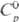 25,39 Дж/(моль · К); DHпл 34,8 кДж/моль (3287 К),
25,39 Дж/(моль · К); DHпл 34,8 кДж/моль (3287 К), 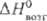 787 кДж/моль (298 К),
787 кДж/моль (298 К), 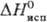 751
кДж/моль (5773 К); 751
кДж/моль (5773 К); 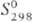 41,6 Дж/(моль·К); т-ра перехода в сверхпроводящее состояние 4,45 К; ур-ние температурной
зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT
(2200-3263 К); температурный коэф. линейного расширения 6,5·10-6
К-1 (293--393 К) и 8,0·10-6 K-1 (293-1773
К); теплопроводность 54,43
Вт/(м·К) при 293 К; rl,32·10-7(0°C) и 8,7· 10-7
Ом·м (2000°С), температурный коэф. r 3,82·10-3 К-1
(0-100°С). Т. парамагнитен, уд. магн. восприимчивость +9,49·10-7 (18°С).
Имеет очень малую величину работы выхода электронов (6,60·10-19 Дж).
41,6 Дж/(моль·К); т-ра перехода в сверхпроводящее состояние 4,45 К; ур-ние температурной
зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT
(2200-3263 К); температурный коэф. линейного расширения 6,5·10-6
К-1 (293--393 К) и 8,0·10-6 K-1 (293-1773
К); теплопроводность 54,43
Вт/(м·К) при 293 К; rl,32·10-7(0°C) и 8,7· 10-7
Ом·м (2000°С), температурный коэф. r 3,82·10-3 К-1
(0-100°С). Т. парамагнитен, уд. магн. восприимчивость +9,49·10-7 (18°С).
Имеет очень малую величину работы выхода электронов (6,60·10-19 Дж).
Примеси H, N,
С и О снижают пластичность и повышают твердость Т. Чистый Т. легко обрабатывается
давлением на холоду; жаропрочен; sраст при 293 К отожженного
образца высокой чистоты 280-330 МПа, неотожженного 600-1400 МПа; относит. удлинение
отожженного и неотожженного образцов соотв. 20-35 и 2-20%; твердость по Бринеллю
чистого отожженного образца 500 МПа. Т. не переходит в хрупкое состояние до
— 211°С.
Химически Т. очень инертен.
В компактном виде начинает окисляться на воздухе выше 300 °С, устойчив к
действию сухих Вr2 и I2 при 150°С, взаимод. с Сl2
выше 200 °С (см. Тантала галогениды), с Н2-выше
250 °С (интенсивно-при 300 °С), с Р2-выше 250 °С, с С
и углеводородами-при 800-1100 °С. Ниже 150°С не раств. в царской водке,
при обычной т-ре-в соляной, фосфорной и серной к-тах, не реагирует с большинством
др. к-т, водным NH3, водными р-рами солей, орг. в-вами.
Не взаимод. с разб. р-рами щелочей, но медленно раств. в их конц. горячих р-рах.
Устойчив к большинству расплавл. металлов (Li, Na, К, Си, Cd, Hg, Sn, Pb, Bi),
но корродирует в расплавл. Fe, Ni и Со. Раств. во фтористоводородной к-те, ее
смесях с HNO3, в горячих конц. H2SO4 и Н3РО4,
в расплавл. щелочах и NH4HF2.
На воздухе Т. покрывается
тончайшей пленкой тантала оксидов. Обратимо поглощает Н2 с
образованием твердого р-ра внедрения (до 30 ат. %Н) и гидрида состава Та2Н
(тетрагон. кристаллич. решетка, а = 0,338 нм, с = 0,341 нм). Р-римость
Н2(мг в 100 г Т.) меняется от 417 при 17 °С до 6,66 при 1300°С,
выше 1500 °С-близка к нулевой. Макс. содержанию растворенного Н2
соответствует ф-ла ТаН0,78. Гидриды Т. образуются также при электролизе
к-т с катодом из Т., при восстановлении Та2О5 гидридом
Са; при взаимод. ТаСl5 с C6H5MgBr в атмосфере
Н2 получены ТаН, ТаН2 и ТаН3. Гидрирование
Т. и дегидрирование при нагр. используют для Получения мелкодисперсного Т.
При взаимод. с углем Т.
дает карбиды Та2С и ТаС. В системе Та-С установлено существование
трех фаз: a (твердый р-р С в Т) и с недостатком С (структуры вычитания)-b(Та2С)
и g(ТаС). При 150°С Т. растворяет 0,02% по массе С; при содержании
С в Та до 2,46% присутствуют a- и b-фазы, при содержании 2,46-3,21%-Та2С
(ТаС0,38 - 0,50), в области концентраций С 3,21-3,71%
-b- и g-фазы, в области 3,71-5,7%-ТаС (ТаС0,58_0,91).
Параметры кристаллич. решетки гексагон. b-фазы изменяются в пределах: а
= 0,31030-0,31044 нм, с = 0,49367-0,49430 нм; кубич. гранецентрир.
g-фазы-в пределах 0,44206-0,44564 нм. Для Та2С: плотн. 15,22
г/см3; 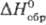 -
208,7 кДж/моль; -
208,7 кДж/моль; 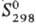 81,7 ДжДмоль-К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °С;
плота. 14,4 г/см3;
81,7 ДжДмоль-К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °С;
плота. 14,4 г/см3;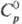 36,8
Дж/(моль · К); 36,8
Дж/(моль · К); 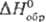 - 142 кДж/моль;
- 142 кДж/моль; 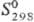 42,4
Дж/(моль · К); весьма устойчив
к хим. реагентам; на воздухе ниже 1000°С не окисляется; раств. только в
смеси HF-HNO3; при нагр. реагирует с N2 и NH3,
образуя нитриды. 42,4
Дж/(моль · К); весьма устойчив
к хим. реагентам; на воздухе ниже 1000°С не окисляется; раств. только в
смеси HF-HNO3; при нагр. реагирует с N2 и NH3,
образуя нитриды.
В системе Ta-N существуют
4 фазы (нитриды): b(TaN0,05), g(TaN0,40_0,45),
d(TaN0,8_0,9) и e (TaN). b-Фаза имеет кубич.
кристаллич. решетку (а = 0,3369 нм;, остальные-гексагональную с параметрами:
для g-фазы а = 0,3041-0.3048 нм, с = 0,4907-0,4918 нм; для
d-фазы а = 0,2925-0,2938 нм, с = 0,2876-0,2883 нм; для e-фазы
а = 0,518 нм, с = 0,2908 нм. При нагр. до 2800-3000 °С нитриды
Т. теряют азот, превращаясь в a-фазу (р-р азота в Т.). Нитриды Т. очень
устойчивы к действию разл. хим. в-в. TaN голубовато-серого или черного цвета;
плотн. 14,36 г/см3;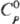 42,7
ДжДмоль · К); D 42,7
ДжДмоль · К); D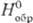 - 252,7 кДж/моль;
- 252,7 кДж/моль; 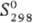 41,9 Дж/(моль·К). Нитриды TaN и Ta2N образуют твердые р-ры соотв.
с ТаС и Та2С. Описана фаза Ta3N5 (красного
цвета), образующаяся при взаимод. Та2О5 с NH3 при
860-920 °С в присут. Ti. Она кристаллизуется в тетрагон. сингонии (а
= 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3.
При высоком давлении N2 получают Ta5N6.
41,9 Дж/(моль·К). Нитриды TaN и Ta2N образуют твердые р-ры соотв.
с ТаС и Та2С. Описана фаза Ta3N5 (красного
цвета), образующаяся при взаимод. Та2О5 с NH3 при
860-920 °С в присут. Ti. Она кристаллизуется в тетрагон. сингонии (а
= 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3.
При высоком давлении N2 получают Ta5N6.
С фосфором Т. образует
фосфиды ТаР и Та2Р, с As-ap-сениды TaAs и TaAs2, с Sb-антимониды
Ta3Sb, Ta5Sb4, TaSb2, с S-сульфиды
TaS3 и TaS2.
Известно 4 устойчивых кристаллич.
силицида: TaSi2 (т. пл. ок. 2200°С, гексагон. кристаллич. решетка,
а = 0,4781 ям, с = 0,6534 нм, плота. 9,14 г/см3), Ta5Si3
(т. пл. ок. 2500 °С, имеет две тетрагон. кристаллич. модификации, для низкотемпературной
а = 0,6516 нм, с = 1,1872 нм), Ta2Si (т. пл. ок. 2450
°С, тетрагон. кристаллич. решетка, a = 0,6157нм, с = 0,5039
нм) и Ta9Si2 (т. пл. ок. 2500 °С, гексагон. кристаллич.
решетка, a = 0,6105нм, с = 0,4918 нм). Компактный TaSi2 устойчив
к окислению на воздухе до 1000 °С и выше. Взаимод. с фтористоводородной
к-той и расплавл. щелочами, устойчив к действию др. минеральных к-т и разб.
р-ров щелочей.
С бором Т. образует бориды
ТаВ2 (т. пл. ок. 3200°С), ТаВ (т. пл. ок. 2000 °С), а также
инконгруэнтно плавящиеся Та2В, Та3В2, Та3В4.
Бесцв. сульфат Ta2(SO4)5
гидролизуется водой, при нагр. выше 100°С разлагается с выделением SO3.
Выделены также Ta2O4SO4·3H2O и соли
типа (NH4)3Та(SO4)4. Фосфаты Т.
имеют состав Та3(РО4)5 и ТаОРО4.
Возможно существование гидрофосфатов, а также пирофосфата (ТаО2)4Р2О7.
Соли гилотетич. танталовых к-т- танталаты получают спеканием Та2О5
с оксидами металлов. См. также Танталорганические соединения.
Получение. Большую
часть Т. получают из пирохлоровых и танталит-колумбитовых концентратов и из
шлаков оловянной плавки. Руды обогащают гравитац. методами и флотацией, а также
электромагн. или радиометрич. сепарацией. Содержание Та2О5
и Nb2O5 в концентратах достигает 50%. Концентраты и шлаки
перерабатывают преим. до Та2О5 иди K2[TaF7]
(значительно реже до ТаС15), из к-рых затем получают металлические
Т. Концентраты и шлаки подвергают выщелачиванию действием фтористоводородной
к-ты с послед. очисткой; Nb и Та разделяют экстракцией трибутилфосфатом, циклогексаноном
или метилизобутил-кетоном, реже-др. экстрагентами. Из водной фазы действием
водным NH3 осаждают гидроксид Т. (к-рый сушат и прокаливают до Та2О5)
или действием KF осаждают K2TaF7.
По хлоридному способу концентрат
смешивают с углем или коксом, брикетируют и хлорируют брикеты в шахтной печи
при 700-800 °С или фторируют непосредственно смесь мелкоизмелъченных концентрата
и кокса в солевом хлорид-ном расплаве, содержащем NaCl и КС1. Далее конденсируют
образовавшиеся летучие пентахлориды Nb и Та, разделяют и очищают ректификацией.
Оксид Та2О5 получают гидролизом ТаС15 с послед.
прокаливанием осадка гидрок-сида Т. Иногда хлорированию подвергают феррониобий
или отходы металла.
По сульфатному способу
концентраты обрабатывают конц. H2SO4 или ее смесью с (NH4)2SO4
при 150-300 °С, выщелачивают сульфаты водой, отделяют осадок, разделяют
и очищают Та и Nb экстракцией из фторидных сред, а затем выделяют Та2О5
или K2TaF7. Разрабатывают способы экстракционного разделения
Та и Nb непосредственно из сульфатных р-ров.
Металлические Т. получают
натриетермич. восстановлением K2TaF7 или электролитич.
восстановлением из расплава K2TaF7-Ta2O5-KF-KCl.
После отмывки полученного порошка Т. от примесей его брикетируют, спекают в
штабики, к-рые переплавляют в вакууме в электродуговых и электроннолучевых печах.
Металлические Т. можно
получить восстановлением Та2О5-карботермически, алюмотермически
или нагреванием в смеси с ТаС в вакууме при 2700 °С.
Описаны спосрбы переработки
концентратов Т. с использованием жидких или газообразных фторирующих реагентов.
Мировое произ-во (в развитых
странах) Т. в виде металла и сплавов ок. 700 т (1985); в т.ч. 2/3
из шлаков оловянной плавки.
Определение. Для
определения Т. применяют те же методы, что и для ниобия. Главная трудность-сходство
хим. св-в Nb и Та, проявление эффекта "потери индивидуальности"
Т. в присут. Nb и Ti. Для разделения этих элементов применяют осаждение Т. из
р-ров таннином, экстракцию, напр. кетонами из р-ров в смеси к-т HCl-HF, купфероном
и др., хроматографич. методы. Количественно Т. определяют колориметрически (с
использованием пирогаллола и др.), гравиметрически, люминесцентным, рентгеноспект-ральными,
флуоресцентными, спектральными и нейтрон-но-активационным методами.
Применение. Ок.
35-45% производимого Т. используют в виде порошка для электролитич. конденсаторов
и при произ-ве деталей электронных приборов, ок. 20-25%-в виде карбидов (ТаС
входит в состав нек-рых твердых сплавов; см. Тантала сплавы), ок.
15-20%-в виде проката, а также присадок к сплавам (напр., добавка Т. в нержавеющие
стали повышает их коррозионную устойчивость), ок. 3-6%-в виде оксидов для ферросплавов.
Из Т. изготовляют аноды, сетки, катоды и др. детали электронных ламп, его применяют
в качестве геттера. В хим. пром-сти Т. служит материалом теплообменников, нагревателей,
зондов для измерения т-ры, кислотоупорной облицовки аппаратов. Из Т. изготовляют
тигли для вакуумного напыления и плавки металлов, фторидов и оксидов. Т.-уникальный
биосовместимый материал, в медицине его используют для костного протезирования.
Нитрид TaN применяют в виде устойчивых к истиранию покрытий, ТаSi2-при
изготовлений структур металл-оксид-полупроводник, защитных и нротивоотражательных
покрытий. См. также Лития танталат.
Т. открыт в 1802 А. Экебергом.
В виде пластичного металла впервые получен в 1905 В. Болтоном.
===
Исп. литература для статьи «ТАНТАЛ»: Константинов
В. И., Электролитическое получение тантала, ниобия и их сплавов, М., 1977; West
wood W. D., Waterhouse N., Wi Icox P. S, Tantalum thin films, L·, 1975. См.
также лит. при ст. Ниобий.
Э. Г. Раков, М. В. Мелкумянц.
Страница «ТАНТАЛ» подготовлена по материалам химической энциклопедии.
|

