|
СЕРА (Sulfur) S,
хим. элемент VI гр. периодич. системы, ат. н. 16, ат. м. 32,066; относится к
халькогенам. Природная С. состоит из четырех изотопов: 32S
(95,084%), 33S(0,74%), 34S(4,16%), 36S(0,016%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 0,52·10-28
м2. Конфигурация внеш. электронной оболочки атома 3s2
3р4; наиб. характерные степени окисления — 2, +4, +6; энергии ионизации
при последоват. переходе от S0 к S6+ равны соотв. 10,3601,
23,35, 34,8, 47,29, 72,5, 88,0 эВ; сродство к электрону 2,0772 эВ; электроотрицательность
по Полингу 2,58; атомный радиус 0,104 нм. ионные радиусы (в скобках даны координац.
числа), нм: S2- 0,170 (6), S4+ 0,051 (6), S6+ 0,026
(4).
С.-довольно распространенный
элемент, среднее содержание в земной коре 0,05 % по массе, в воде морей и океанов
0,09%. Известны многочисл. минералы С.: самородная С. (главные месторождения
в США, СНГ, Мексике, Италии, Японии); сульфидные минералы-пирит FeS2,
антимонит Sb2S3, галенит PbS, киноварь HgS, сфалерит и
вюрцит ZnS, ковеллин CuS, халькозин Cu2S, аргентит Ag2S,
висмутин Bi2S3, халькопирит CuFeS2 и др.; сульфаты
-барит BaSO4, ангидрит CaSO4, гипс CaSO4·2H2O,
мирабилит Na2SO4 x x 10Н2 О и др.
Кроме того, С. присутствует в виде соед. в углях, сланцах, нефти, прир. газах.
С.-биогенный элемент, входит в состав белков, витаминов.
Свойства. До 95,39°С
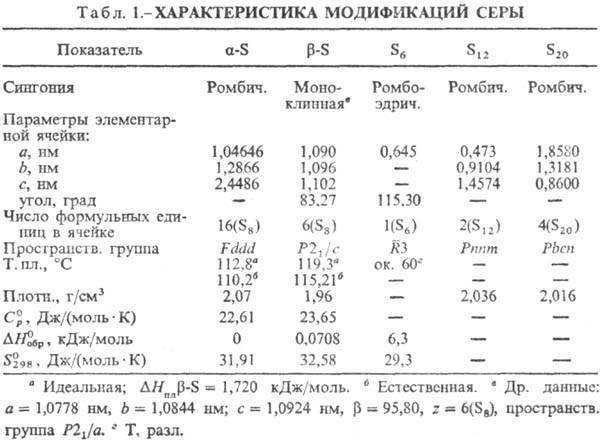
стабильна a-S-при комнатной т-ре лимонно-желтые кристаллы (табл. 1); выше
95,39° С стабильна b-S-при комнатной т-ре бледно-желтые кристаллы,
DН перехода a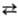 b
0,400 кДж/моль. Кристаллич. структура a- и b-S построена из неплоских
восьмичленных циклич. молекул S8 в виде короны. a- и b-S
различаются взаимной ориентацией молекул S8 в кристаллич. решетке. b
0,400 кДж/моль. Кристаллич. структура a- и b-S построена из неплоских
восьмичленных циклич. молекул S8 в виде короны. a- и b-S
различаются взаимной ориентацией молекул S8 в кристаллич. решетке.
С. легко образует циклич.
молекулы с разным числом атомов п. Для циклич. молекул найдены след.
значения энергии связи (Е, кДж/моль) S—S:
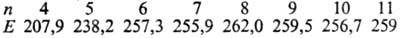
Цикл S8 предпочтителен,
др. циклы менее устойчивы, особенно S5 и S4. Получены
метастабильные модификации от оранжевого (S6) до лимонно-желтого
(S20) цвета.
При быстром охлаждении
бензольного р-ра С. получена метастабильная, т. наз. перламутровая, С, содержащая
в структуре циклы S8, отличающиеся по конфигурции от молекул S8
a- и b-S. Известна ромбоэдрическая С., образованная молекулами S6.
Аморфную [плотн. 1,92 г/см3, 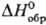 0,397 кДж/моль,
0,397 кДж/моль, 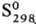 33,18
Дж/(моль·К)] и пластическую
(резиноподобную) С. получают при резком охлаждении расплавленной С.; напр.,
пластич. форму - выливанием расплава С. с т-рой 190°С в холодную воду. Эти
формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm.
Аморфная и все др. формы С. превращ. в a-S при длит. выдерживании их при
20-95°С. При 96-110°С аморфная и все др. формы С., в т.ч. а, переходят
в b-S. При давлении 1,6-2,7 ГПа С. претерпевает новые полиморфные превращения.
Ур-ния температурной зависимости давления пара: над a-S lgp(Па)
= 16,557--5166/Т (20-80 °С), над b-S lgp(Па) = 16,257-5082/Т
(96-116°С). Твердые и жидкая формы С. диамагнитны, магн. восприимчивость
a-S — 1,56·10-7, b-S — 1,4·10-7. Парамагнитна
молекула S2. a-S относят либо к высокоомным полупроводникам,
либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, r 1,9·1017
Ом·см; температурный коэф. линейного расширения 4,567·10-5°С-1
(0-13°С), 2,67 x x 10-6°С-1 (78-97°С),
10,32°С-1 (98-110°С); теплопроводность 1,994 Вт/(см·К). 33,18
Дж/(моль·К)] и пластическую
(резиноподобную) С. получают при резком охлаждении расплавленной С.; напр.,
пластич. форму - выливанием расплава С. с т-рой 190°С в холодную воду. Эти
формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm.
Аморфная и все др. формы С. превращ. в a-S при длит. выдерживании их при
20-95°С. При 96-110°С аморфная и все др. формы С., в т.ч. а, переходят
в b-S. При давлении 1,6-2,7 ГПа С. претерпевает новые полиморфные превращения.
Ур-ния температурной зависимости давления пара: над a-S lgp(Па)
= 16,557--5166/Т (20-80 °С), над b-S lgp(Па) = 16,257-5082/Т
(96-116°С). Твердые и жидкая формы С. диамагнитны, магн. восприимчивость
a-S — 1,56·10-7, b-S — 1,4·10-7. Парамагнитна
молекула S2. a-S относят либо к высокоомным полупроводникам,
либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, r 1,9·1017
Ом·см; температурный коэф. линейного расширения 4,567·10-5°С-1
(0-13°С), 2,67 x x 10-6°С-1 (78-97°С),
10,32°С-1 (98-110°С); теплопроводность 1,994 Вт/(см·К).
Мн. модификации С. характеризуются
"идеальной" т-рой плавления-для С, расплав к-рой перед кристаллизацией
содержал практически один сорт молекул (в осн. S8), и "естественной"
т-рой плавления-для С., расплав к-рой перед кристаллизацией длительно выдерживался
и в результате содержал смесь разл. молекул (такие расплавы обозначают Sl,
Sp, Sm). Напр., для перламутровой С. идеальная
т. пл. 106,8 °С, естественная т. пл. 103,5 °С. Sl отделяют
от Sp и Sm обработкой CS2, в к-ром.
Sl раств., а Sp (содержит полимерные цепи из
S8) и Sm (содержит полимерные цепи из одноатомной
S)-нет.
Расплав С. вблизи т-ры
плавления-подвижная желтая жидкость, содержит циклич. молекулы S8
и, в незначит. степени, Sn, где n = 6, 7, 9, 10; h
0,011 Па·с (120 °С), g 60,83 мН/м (120°С). При нагр. выше 120°С
циклич. молекулы превращ. в полимерные цепи Sm, процесс протекает
заметно при ~ 160 °С, этой же т-ре отвечает максимум (159,6 °С) на кривой
зависимости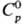 от
т-ры; h резко увеличивается от 6,5·10-3 Па·с (155°С) до
93,3 Па·с (187°С); g 56,67 мН/м (150°С). При 187°С расплав
темно-коричневого цвета, практически нетекуч. При нагр. выше 187°С цепи
разрываются, укорачиваются, жидкость вновь становится подвижной, напр. h
при 355°С 0,432 Па·с, при 444°С 0,083 Па·с; ур-ния температурной зависимости:
плотности d = 1,9035 — - 0,000832/ (120 < t < 155 °С),
d = 1,8818 - 0,0006235t (157 < <t<444°С),
давления пара над жидкой С. lgp (мм рт. ст.) = 12647 - 46,433·105/T
- 12,96T + 6,0625 · 10-3 Т2 (388 <
Т< 742 К); tкрит 1040°С, pкрит
11,8 МПа, dкрит 0,119 г/см3. от
т-ры; h резко увеличивается от 6,5·10-3 Па·с (155°С) до
93,3 Па·с (187°С); g 56,67 мН/м (150°С). При 187°С расплав
темно-коричневого цвета, практически нетекуч. При нагр. выше 187°С цепи
разрываются, укорачиваются, жидкость вновь становится подвижной, напр. h
при 355°С 0,432 Па·с, при 444°С 0,083 Па·с; ур-ния температурной зависимости:
плотности d = 1,9035 — - 0,000832/ (120 < t < 155 °С),
d = 1,8818 - 0,0006235t (157 < <t<444°С),
давления пара над жидкой С. lgp (мм рт. ст.) = 12647 - 46,433·105/T
- 12,96T + 6,0625 · 10-3 Т2 (388 <
Т< 742 К); tкрит 1040°С, pкрит
11,8 МПа, dкрит 0,119 г/см3.
Т. кип. С. 444,6 °С,
DHисп 9,2 кДж/моль. Пар содержит молекулы Sn,
где n = 2-12 (табл. 2). при 150°С в паре преобладают молекулы S8,
в меньшей степени присутствуют S6 и S7, при 444,6 °C-S8,
S6, S7, незначительно S2, при 600°C-S8,
S6, S7 в равных кол-вах, меньше S2, при 700°С-примерно
в равных кол-вах S2, S6, S8, S7,
незначительно S3, выше 730 °C преобладают молекулы S2,
выше 1500°С-одноатомная S.
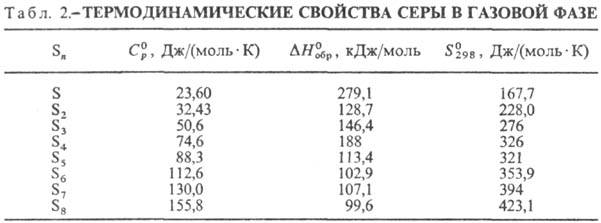
С. не раств. в воде, плохо
раств. в этаноле, гептане, гексане, лучше-в толуоле, бензоле (табл. 3). Лучшие
р-рители для С.-жидкий NH3 (под давлением), CS2, S2C12.
Последние два используют
в пром-сти как р-рители С, S2Сl2-при вулканизации каучука;
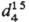 р-ров С. в CS2
(в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20).
С., содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2.
В расплавленной С. заметно раств. H2S, SO2, As2S3,
P2S5 и др. р-ров С. в CS2
(в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20).
С., содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2.
В расплавленной С. заметно раств. H2S, SO2, As2S3,
P2S5 и др.
Конц. Н2 SO4
окисляет расплавленную С. при ~120°С до SO2, конц. HNO3,
смеси соляной к-ты с окислителями (КС1О3, НNО3)-до H2SO4.
Разб. HNO3, соляная к-та без добавок окислителей, Н2 SO4
на холоду с С. не реагируют. Мелкодисперсная С. взаимод. при нагр. с р-рами
щелочей, давая сульфиты и сульфиды, а затем полисульфиды и тио-сульфаты. С.
непосредственно соединяется почти со всеми элементами, кроме инертных газов,
иода, азота, Pt, Аu. При 280°С сера горит в О2, а при 360°С
в воздухе, образуя в осн. серы диоксид, а также серы триоксид. Смесь
паров С. и О2 взрывается.
Оксиды С., кроме SO2
и SО3, неустойчивы. S2О-газ; 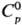 44,3 Дж/(моль·К);
44,3 Дж/(моль·К); 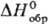 -108,9 кДж/моль;
-108,9 кДж/моль;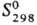 267,3
Дж/(моль·К); образуется
при пропускании SO2 в тлеющем разряде. Кристаллич. S8O
образуется при взаимод. Н28„ с SOC12, жидкий SО4
(т. пл. 3°С, с разл.)-из SO2 и О2 в тлеющем разряде
при —190 °С. Жидкий S2O7 (т. пл. 0°С, 267,3
Дж/(моль·К); образуется
при пропускании SO2 в тлеющем разряде. Кристаллич. S8O
образуется при взаимод. Н28„ с SOC12, жидкий SО4
(т. пл. 3°С, с разл.)-из SO2 и О2 в тлеющем разряде
при —190 °С. Жидкий S2O7 (т. пл. 0°С, 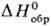 — 811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении
SO4. Соед. SO4 и S2 O7 содержат
пероксидную группировку —О—О—, формально им соответствуют пероксомоносерная
к-та (к-та Каро) H2SO5 (т. пл. 47°С, с разл.) и пероксодисерная
к-та Н2S2О8 (т. пл. 65 °С, с разл.), к-рые
образуются при электролизе H2SO4 или гидросульфатов при
произ-ве Н2О2. Известны также S6O и S7O2.
— 811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении
SO4. Соед. SO4 и S2 O7 содержат
пероксидную группировку —О—О—, формально им соответствуют пероксомоносерная
к-та (к-та Каро) H2SO5 (т. пл. 47°С, с разл.) и пероксодисерная
к-та Н2S2О8 (т. пл. 65 °С, с разл.), к-рые
образуются при электролизе H2SO4 или гидросульфатов при
произ-ве Н2О2. Известны также S6O и S7O2.
С галогенами, кроме I2,
С. образует серы галогениды, с водородом - сероводород, сульфаны,
с углеродом - сероуглерод, с металлами и более электроположит., чем
С., неметаллами-сульфиды (см. Сульфиды неорганические), с Se-фазу с широкой
областью гомогенности (50-60% ат. % Se), с Те при сверхвысоких давлениях-Te7S10.
Известны нитриды С.: циклич. S4 N4, к-рый при нагр. над
Ag превращается в др. соед., молекулы к-рого представляют собой плоские циклы
S2N2; (SN)x (образуется при полимеризации
S2N2)-золотистое в-во с металлич. проводимостью, вблизи
0 К-сверхпроводник; S4N2 и др. Известны соед., содержащие
С. в катионной форме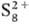 , ,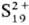 и
др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3].
О к-тах С., их солях см. Политионаты, Серная кислота, Сульфаты неорганические,
Сульфиты неорганические, Тиосульфаты неорганические и др.,-об орг. соединениях
С.-Сераорганические соединения и др. и
др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3].
О к-тах С., их солях см. Политионаты, Серная кислота, Сульфаты неорганические,
Сульфиты неорганические, Тиосульфаты неорганические и др.,-об орг. соединениях
С.-Сераорганические соединения и др.
Получение. С. добывают
из самородных руд, а также получают окислением H2S или восстановлением
SO2. Существует неск. методов добычи. С. из руд: 1) геотехнологический
метод переработки самородной С. заключается в выплавке С., находящейся в недрах
Земли, без подъема руды на пов-сть. В серосодержащий пласт подают под давлением
по трубам водяной пар, сжатым воздухом расплавленную С. поднимают на пов-сть.
2) По термическому методу С. либо выплавляют из дробленой руды в камерных печах,
либо возгоняют во вращающихся печах. 3) Экстракционный метод (применяется ограниченно)
состоит в извлечении С. из руд сероуглеродом. 4) Пароводяной метод (для руд
с высоким содержанием С.) заключается
в обработке дробленой руды в автоклавах острым Паром. 5) Флотационные методы
предусматривают обогащение руд и затем извлечение С. пароводяным методом; вводятся
реагенты для увеличения гидрофиль-ности частиц руды и гидрофобности С. 6) При
получении С. методом флокуляции концентрат поступает а плавильник, оттуда
во флокулятор, где к образовавшейся суспензии добавляют коагулянт (высококипящая
жидкость, содержащая воду), затем флокулы пустой породы отделяют от жидкой С.
С. получают из H2S
пром. газов (генераторный, коксовый, газы нефтепереработки) и прир. газов: 1)
извлекают H2S из газа щелочными р-рами, затем перерабатывают десорбиро-ванный
H2S методом контактного окисления-часть H2S окисляется
до SO2 (сгорание), после чего смесь H2S и SO2 реагирует
на слое боксита при 270-300 °С, давая С. и Н2О. 2) В процессе
сухой очистки газа H2S на фильтре с активир. углем окисляется при
40 °С до С. и Н2О.
Из SO2 С. получают
в сочетании с выплавкой Fe и Си из сульфидных руд. В печи в шихте (руда, кокс,
кварц, известняк) вначале отщепляется один атом S от FeS2, затем
FeS окисляется с образованием SO2, к-рый восстанавливается коксом
до С. Газ, выходящий при ~ 450 °С, содержит пары S, SO2, COS,
CS2, H2 S; его очищают от пыли и направляют в первый контактный
аппарат, где на боксите при 450 °С COS и CS2 реагируют с SO2
с выделением С. При переработке SO2 из отходящих газов цинкового
(из ZnS) и др. произ-в также получают С.
Сорта С.: выплавленную
из самородных руд С. наз. природной комовой, полученную из H2S и
SO2-гa-зовой комовой, природную комовую, очищенную пере-гонкой,-рафинированной,
сконденсированную из паров выше т-ры плавления и разлитую из жидкого состояния
в формы-черенковой, сконденсированную в твердое состояние-серным цветом. Высокодисперсную
С. наз. коллоидной.
Для рафинирования С. используют
хим. методы-путем перевода примесей в др. степени окисления с послед. их отделением.
Для уменьшения содержания As и Se С. обрабатывают смесью конц. HNO3
и H2SO4, отмывают от к-т, кипятят с обратным холодильником
и сублимируют в вакууме. Для очистки от углерода (битумов) используют хим.-термич.
метод-нагревают С. в кварцевом реакторе при ~ 800 °С, при этом углеродсодержащие
в-ва обугливаются и легко отделяются.
Глубокую очистку С. в осн.
осуществляют дистилляцией и ректификацией. Для дальнейшей очистки С. от примесей
(Н, С, О, Se, As и др.) перспективны кристаллизац. методы, среди них-способ
противоточной кристаллизации из расплава. Получена высокочистая С. с содержанием
примесей 10-5-10-6 % по массе.
Определение. Качественно
и количественно С. определяют путем перевода в р-римые сульфаты, а затем в BaSO4.
Прир. объекты обрабатывают соляной к-той, затем отгоняют Н2 S. Свободную
С. извлекают бензолом, пиритную-разб. HNO3, в составе орг. соед.-смесью
HNO3 с КМnО4. Для определения С. в сталях и ферросплавах
пробу раств. в смеси соляной и азотной к-т, затем Fe(III) переводят в Fe(II),
удаляют NО-3 , определяют С. в виде BaSO4.
В воздухе С. определяют колориметрически-сжигают С. в токе О2, окисляют
образовавшийся SO2 до Н2 SO4 и определяют ее
в виде BaSO4 в водно-спиртовом р-ре. Для определения малых кол-в
(10-4 %) С. применяют фотоколориметрич. метод-после обработки пробы
с получением H2S, поглощение H2S р-ром щелочи, С. определяют
по изменению окраски метиленового синего.
Применение. Ок. 50% производимой
С. используют для произ-ва H2SO4, ок. 25%-для получения
сульфитов, 10-15%-для борьбы с вредителями с.-х. культур (гл. обр. винограда
и хлопчатника), ок. 10%-в резиновой пром-сти (как вулканизующий агент). С. применяют
в произ-ве красителей, ВВ, искусств. волокна, люминофоров, CS2, сульфидов,
в орг. синтезе и др., она входит в состав головок спичек, мазей
для лечения кожных заболеваний. Небольшие добавки С. улучшают обрабатываемость
автоматных сталей и анти-фрикц. св-ва спеченных антифрикц. материалов.
Мировое произ-во С. 53
млн. т (1984).
Соединения С. по отрицат.
воздействию на окружающую среду занимают одно из первых мест среди загрязняющих
в-в. Осн. источник загрязнения соединениями С.-сжигание угля и нефтепродуктов.
96% С. поступает в атмосферу в виде SO2, остальное кол-во приходится
на сульфаты, H2S, CS2, COS и др. В виде пыли элементная
С. раздражает органы дыхания, слизистые оболочки, может вызывать экземы и др.
ПДК в воздухе 0,07 мг/м3 (аэрозоль, класс опасности 4). Мн. соед.
S токсичны.
С. известна с глубокой
древности, ее начали использовать ок. 2000 до н. э.; напр., в Египте ее применяли
для дезинфек-ции, беления тканей и др.
===
Исп. литература для статьи «СЕРА»: Авдеева А.
А., в сб.: Основы металлургии, т. 5, М., 1968, с. 483-504; Справочник сернокислотчика,
под ред. К. М. Малина, 2 изд., М., 1971; Ьу-севА. И., Симонова Л.Н., Аналитическая
химия серы, М., 1975; Глобальный биогеохимический цикл серы и влияние на него
деятельности человека, М., 1983; Чурбанов М.Ф., Скрипачев И. В., "Высокочистые
вещества", 1988, № 3, с. 92-107. И. Н. Один.
Страница «СЕРА» подготовлена по материалам химической энциклопедии.
|

