|
ПЕРОКСИДНЫЕ
СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ, содержат группировку из связанных между собой
двух атомов О. Различают собственно пероксиды ROOR' (R и R' орг. радикалы),
гидропероксиды ROOH и озониды, напр. соед. ф-лы I.
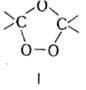
В пероксидных соед. (II.)
один или оба радикала м. б. присоединены к группе OO через гетероатомы, напр.
P, S, Si, металл и др. (элементоорг. пероксиды). П. включают след. типы соед.:
пероксиды и гидропероксиды алкилов и аралкилов; ацилгидропероксиды RC(O)OOH
(пероксикислоты, надкислоты, перкислоты); пероксиэфиры RC(O)OOR'; диацилпероксиды
RC(O)OOC(O)R'; эфиры моно- и ди-пероксиугольной к-т ROC(O)OOR' и (ROO)2
СО; пероксиди-карбонатм ROC(O)OOC(O)OR'; алкилпероксикарбаматы ROOC(O)NHR';
.гем-дипероксиды RR'C(OOR')2; циклич. пероксиды, содержащие
группу OO в цикле, напр. 1,2-ди-оксетан; пероксиды, содержащие гидрокси-,
гидроперокси- и др. группы, напр. 1-гидроксигидропероксиды RR'C(OH)OOH, пероксиды
1-гидроксиалкилов [RR'C(OH)O—]2, гидрок-си(гидроперокси)пероксиды
RR'C(OH)OOC(OOH)RR', пероксиды 1-гидропероксиалкилов [RR'C(OOH)O—]2.
В природе II. находят в
продуктах окисления орг. в-в; из хеноиодиевого масла выделен циклич. пероксид-
аскаридол; в атмосфере фотохим. смога обнаружены пероксинитраты. П.-интермедиаты
биосинтеза простагландинов и стероид-ных гормонов; влияют на активность мембраносвязанных
ферментов липидного обмена. П.-жидкости (метилперо-ксид CH3OOCH3
-газ, т. кип. 13 0C) или твердые в-ва, напр. ацетила пероксид;
обычно плохо раств. в воде, хорошо-в орг. р-рителях; легко воспламеняются
и горят, нек-рые со взрывом (с увеличением мол. массы их взрывчатые св-ва уменьшаются).
При нагр., ударе и попадании загрязнений П. могут разлагаться, в нек-рых случаях
со взрывом; особенно опасно попадание даже следовых количеств тяжелых металлов
и их солей. Нек-рые П., напр. кремнийорг. пероксиды, стабильны
до 100 0C и выше. Работа с П. требует большой осторожности.
ИК спектры П. имеют характеристич.
полосы при 830 890 см-1 (валентные колебания группы ОО, слабое поглощение),
3545-3562 см-1 (валентные колебания H O в своб группе HOO), для группы
C=O поглощение в области 1750-1760 см-1 (пероксиэфиры), 1740-1760
cм--1 (пероксикислоты), дублет 1780 1820 и 1760 1796см-1
(диацилпероксиды). Пероксидная группа слабо поглощает в области 350-250 нм.
В спектрах комбинац. рассеяния наиб. интенсивная полоса поглощения в области
820 900 см-1 (валентные колебания группы ОО).
Потенциалы полуволн восстановления
на ртутном капельном электроде (относительно нормального каломельного электрода)
для гидропероксидов 0,6-0,9; пероксикислот 0-0,1; диацилпероксидов 0,1-0,2;
пероксиэфиров 0,8 1,1, пероксидов алкилов и аралкилов 1,4-2,1 В.
П.-термически нестабильны,
термолиз их протекает обычно по связи О—О с образованием своб. радикалов, напр.:
ROOR' —> RO• + •OR' (см. табл.).
ТЕРМИЧЕСКИЙ РАСПАД ОРГАНИЧЕСКИХ
ПЕРОКСИДОВ В УГЛЕВОДОРОДНЫХ РАСТВОРИТЕЛЯХ
|
|
|
|
|
|
|
|
|
|
Энергия активации.
кДж/моль
|
|
|
|
Пероксидикарбонаты
ROC(O)OOC(O)OR
|
|
|
|
|
|
Диацилпероксиды
RC(O)OOC(O)R
|
|
|
|
|
|
|
|
|
|
|
|
гем-Дипероксиды
(ROO)2CR'R''
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* Т-ра, при к-рой за 10
ч распадается 1/2 в-ва.
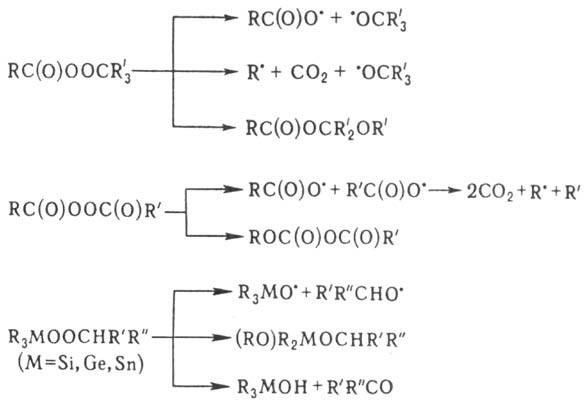
При термолизе пероксиэфиров,
несимметричных диацилпероксидов, пероксидов, содержащих a-H-атомы,
а также элементоорг. пероксидов наряду с гомолизом происходят перегруппировки,
напр.:
При гомолитич. распаде
в р-рителях первичные радикалы могут отрывать атом H от молекулы р-рителя с
образованием вторичных радикалов, к-рые димеризуются, напр.:
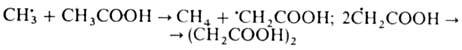
Гидропероксиды легко образуют
своб. радикалы при взаимод. с переходными металлами, напр.:
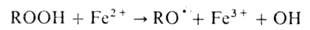
a-Гидроксигидропероксиды
в присут. воды распадаются с выделением H2O2 (один из
пром. методов получения пе-роксида водорода); для алкоксигидропероксидов требуется
нагревание с водой, напр.:
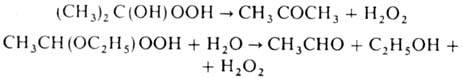
Гидропероксиды слабые к-ты
и дают соли со щелочными и щел.-зем. металлами, что часто используется для их
выделения.
При действии HI, SnCl2,
LiAlH4 и др. гидропероксиды восстанавливаются до спиртов; восстановление
пероксидов происходит с трудом и неполно.
П. окисляют амины, фосфины,
сульфиды и др. (см., напр., Бензоилпероксид, трет-Бутилгидропероксид);
пероксикисло-ты эпоксидируют олефины (см. Надбензойная кислота, Над-уксуспая
кислота). Радикалы диацилпероксидов, образующиеся при их разложении, присоединяются
к олефинам и особенно к их производным (виниловым мономерам), инициируя радикальную
полимеризацию:

Диацилпероксиды, диалкилпероксидикарбонаты,
перокси-эфиры и др. широко используются в качестве инициаторов полимеризации.
Пероксидная группа вводится
в орг. молекулу действием O2, O3, H2O2
или его солей, а также р-циями с другими П.
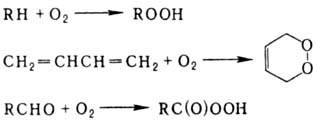
Автоокисление углеводородов
приводит к гидроперокси-дам и пероксидам, а автоокисление альдегидов - к перокси-кислотам:
Пероксиды и гидропероксиды
образуются также при прямом алкилировании H2O2 и его солей
спиртами, эфирами, алкилгалогенидами, диалкилсульфатами и др.:
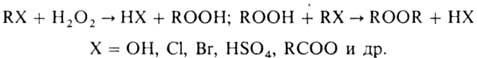
Ацилирование H2O2,
ROOH и их солей к-тами, ангидридами, хлорангидридами и др. в присут. к-т и оснований
приводит к образованию пероксикислот (р-ция 1), диацилпероксидов (2, 3), пероксиэфиров
(4):
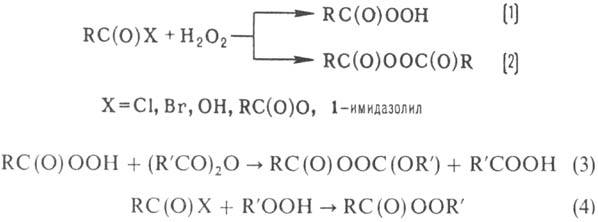
При взаимод. карбонильных
соед. с H2O2 или гидропе-роксидами в зависимости от условий
получают разл. П., напр.
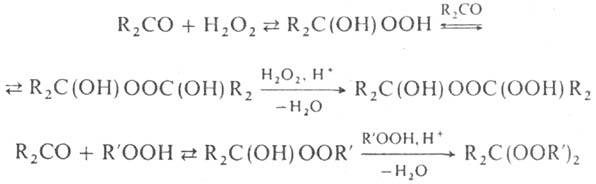
Элементоорг. пероксиды
получают автоокислением эле-ментоорг. соед. Mg и Tl; пероксидные соед. Mg можно
применять для синтеза других П.:
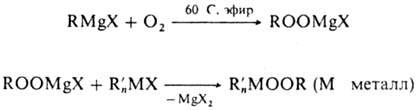
X галоген, алкоксигруппа
и др.
Элементоорг. пероксиды
м.б. получены также нуклеоф. замещением функц. групп металлоорг. соединений
на ал-килпероксидную группу; в качестве исходных пероксидов используют алкилгидропероксиды
или их соли (Li, Na, К):
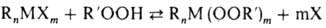
R = Alk, Ar, OAlk, OAr;
X = H, ОН, NH2, Hal, Alk. Ar, OAlk, OAr, OAc и др.; n  1,
т 1,
т  1
(определяются валентностью металла) 1
(определяются валентностью металла)
Для нек-рых металлоорг.
соед. эта р-ция протекает обратимо, и для смещения равновесия в сторону образования
пероксидов вводят основания (NH3, амин и др.) или водо-отнимающие
ср-ва (безводный Na2SO4 или MgSO4).
Р-ции нуклеоф. замещения
применяют также для синтеза соед. типа RnMOOMRn
или RnMOOM'Rm (R = Alk, Ar; M = Tl, Si, Ge, Sn;
M' = Si, Ge, Pb, Sb; n = 2,3; т = 3,4).
Озониды (см. ф-лу I) получают
действием O3 на непредельные соединения.
Для определения П. наиб.
широко используют иодомет-рич. метод, основанный на количеств. выделении иода
из р-ров KI, напр.:
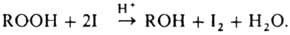 Реакц.
способность П. в этой
р-ции снижается в ряду перо-ксикислоты > диацилпероксиды > гидропероксиды
> озони-ды > пероксиэфиры > алкилпероксиды. Для анализа применяют также
хроматографию, спектроскопию, полярографию. Реакц.
способность П. в этой
р-ции снижается в ряду перо-ксикислоты > диацилпероксиды > гидропероксиды
> озони-ды > пероксиэфиры > алкилпероксиды. Для анализа применяют также
хроматографию, спектроскопию, полярографию.
П. широко используют во
мн. отраслях народного хозяйства при синтезе и переработке полимеров в качестве
инициаторов полимеризации и теломеризации, вулканизующих агентов. П. исходное
сырье в многотоннажных произ-вах получения ацетона, фенола, H2O2
на основе кумилгидропе-роксида и др.
П. применяют также как
отбеливатели тканей и пищ. продуктов, добавки к дизельному топливу. Из Элементоорг.
пероксидов используют ацетилциклогексилсульфонилперо-ксид C6H11SO2OOC(O)CH3
в качестве инициатора суспен-зионной и эмульсионной полимеризации, кремнийорг.
пе-роксид [(CH3)3COO]3SiCH=CH2 как
вулканизующий агент.
П. раздражают кожу и слизистые
оболочки.
В мире производится ок.
100 различных П. в чистом виде, а также в виде паст, смесей с мелом, суспензий.
Произ-во П. в США ок. 30-40 тыс. т/год (1980).
Лит.. Антоновский
В. Л.. Органические перекисные инициаторы. M., 1972; Антоновский В. Л., Бузланова
M. M., Аналитическая химия органических пероксидных соединений, M., 1978; Organic
peroxides, ed. by D. Swern, v. 1 3, N.Yn 1970 72; The chemistry
of peroxJdes, ed. by S. Patai, Chichester, 1983 В. Л Антоновский.
===
Исп. литература для статьи «ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ»: нет данных
Страница «ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ ОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

