|
ОСМИЙ (от греч.
osme-запах; лат. Osmium) Os, хим. элемент VIII гр. периодич. системы; ат.н.
76, ат.м. 190,2; относится к платиновым металлам. В природе семь стабильных
изотопов: 184Os (0,018%), 186Os (1,59%), 187Os
(1,64%), 1880s (13,3%), 1890s (16,1%), 1900s
(26,4%), 192Os (41,1%). Конфигурация внеш. электронных оболочек атома
5d66s2; степени окисления +4, +6, +8 (наиб, характерны),
+ 1, +3, +5; энергии ионизации Os0  Os+ Os+
 Os2+
8,5 эВ, 17 эВ; электроотрицательность по Полингу 2,1; сродство к электрону 1,44
эВ; атомный радиус 0,135 нм, ионные радиусы (в скобках приведены координац.
числа) для Os4+ 0,077 нм (6), Os5+ 0,072 нм (6), Os6+
0,069 нм (6), Os7+ 0,067 нм (6), Os8+ 0,053 нм (4). Os2+
8,5 эВ, 17 эВ; электроотрицательность по Полингу 2,1; сродство к электрону 1,44
эВ; атомный радиус 0,135 нм, ионные радиусы (в скобках приведены координац.
числа) для Os4+ 0,077 нм (6), Os5+ 0,072 нм (6), Os6+
0,069 нм (6), Os7+ 0,067 нм (6), Os8+ 0,053 нм (4).
Содержание О. в земной
коре 5.10-6 % по массе. Относится к редким и рассеянным элементам.
Осн. минералы О.: прир. сплавы Os и Ir-осмистый иридий (невьянскит и сысертскит);
кроме Os и Ir они содержат еще неск. ми-нералообразующих элементов и относятся
к классу твердых р-ров. О. встречается также в виде соед. с S и As (эр-лихманит,
осмиевый лаурит, осарситт). В качестве изоморфной примеси входит в состав халькопирита,
пирротина, пентландита, кубанита, магнетита. Извлекают О. из руд медно-никелевых
и медно-молибденовых месторождений.
Свойства. О.-блестящий
серебристо-голубоватый металл, твердый. Кристаллич. решетка гексагональная типа
Mg, а = 0,27353 нм, с = 0,43191 нм, z = 2, пространств.
группа P63/mmc; т. пл. 3027 °С, т. кип. 5027 °С;
плотн. 22,61 г/см3; 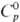 24,7 Дж/(моль·К);
24,7 Дж/(моль·К); 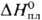 31,8 кДж/моль,
31,8 кДж/моль, 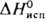 747,4 кДж/моль;
747,4 кДж/моль; 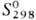 32,6 Дж/(моль · К); давление пара 2,59 Па (3000 °С), 133 Па (3240 °С);
1,ЗЗкПа (3640 °С), 13.3 кПа (4110°С); температурный коэф. линейного
расширения 5·10-6 К-1 (298 К); теплопроводность 0,61 Вт/(см·К);
32,6 Дж/(моль · К); давление пара 2,59 Па (3000 °С), 133 Па (3240 °С);
1,ЗЗкПа (3640 °С), 13.3 кПа (4110°С); температурный коэф. линейного
расширения 5·10-6 К-1 (298 К); теплопроводность 0,61 Вт/(см·К);
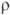 9,5 мкОм·см (20°С), температурный коэф.
9,5 мкОм·см (20°С), температурный коэф. 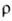 4,2·10-3 К-1;
4,2·10-3 К-1; 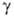 жидкого О. 0,025 Н/см; парамагнетик, магн. восприимчивость + 9,9·10-6;
т-ра перехода в сверхпроводящее состояние 0,66 К; твердость по Виккерсу 3-4
ГПа, по Моосу 7; модуль нормальной упругости 56,7 ГПа; модуль сдвига 22 ГПа.
жидкого О. 0,025 Н/см; парамагнетик, магн. восприимчивость + 9,9·10-6;
т-ра перехода в сверхпроводящее состояние 0,66 К; твердость по Виккерсу 3-4
ГПа, по Моосу 7; модуль нормальной упругости 56,7 ГПа; модуль сдвига 22 ГПа.
Тонко измельченный порошок
О. медленно окисляется на воздухе до OsO4 при комнатной т-ре, может
на воздухе гореть при нагревании. В компактном состоянии О. устойчив к окислению
до 400 °С. Компактный О. не раств. в горячей соляной к-те и кипящей царской
водке. Мелкодисперсный
О. окисляется HNO3 и кипящей H2SO4 до OsO4,
при нагр. реагирует с F2, Сl2, Р, Se, Те и др. Металлич.
Os м. б. переведен в р-р сплавлением со щелочами в присут окислителей, при этом
образуются соли неустойчивой в своб. состоянии осмиевой к-ты Н2ОsО4-осматы(VI).
При взаимод. OsO4 с КОН в присут. этанола либо р-цией с KNO2
получают также осмат(VI) K2[OsO2(OH)4], или
K2OsO4·2H2O. Осматы(VI) восстанавливаются этанолом
до гидроксида Os(OH)4 (черного цвета), к-рый в атмосфере N2
обезвоживается до диоксида OsO2. Известны пе-росматы M2[OsO4X2],
где X = ОН, F, образующиеся при взаимод. р-ра OsO4 с конц. р-ром
щелочи.
СВОЙСТВА СОЕДИНЕНИЙ
ОСМИЯ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
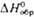 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
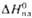 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
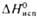 , кДж/моль
, кДж/моль
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* а = 0,9379 нм,
b = 0.415 нм. с = 0,8632 нм. **DH0возг 57.5
кДж/моль *** Т-ра возгонки.
Тетраоксид OsO4
обладает резким неприятным запахом; 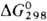 — 302,2 кДж/моль;
— 302,2 кДж/моль; 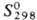 137 Дж/(моль·К) (см. также табл.); давление пара 66,5 Па (0°С, 532 Па (23
°С), 27,3 кПа (91 °С); р-римость (г в 100 г): в воде 5,7 (10 °С),
6,23 (25 °С), в ССl4-250 (20 °С); раств. в этаноле, диэтиловом
эфире, водном NH3; взаимод. со щелочами с образованием красно-бурых
р-ров: OsO4 + NaOH
137 Дж/(моль·К) (см. также табл.); давление пара 66,5 Па (0°С, 532 Па (23
°С), 27,3 кПа (91 °С); р-римость (г в 100 г): в воде 5,7 (10 °С),
6,23 (25 °С), в ССl4-250 (20 °С); раств. в этаноле, диэтиловом
эфире, водном NH3; взаимод. со щелочами с образованием красно-бурых
р-ров: OsO4 + NaOH Na2[OsO4(OH)2];
сильный окислитель; получают при нагр. металлического О. на воздухе, а также
окислением соединений О. в низших степенях окисления; окислитель в орг. синтезе,
катализатор в р-циях гидроксилирования; благодаря легкости восстановления OsO4
орг. соединениями до OsO2 или до Os разб. водные р-ры OsO4
используют для окраски биол. препаратов; токсичен, действует на слизистые оболочки
глаз, носа и рта, ПДК 0,002 мг/м3. Na2[OsO4(OH)2];
сильный окислитель; получают при нагр. металлического О. на воздухе, а также
окислением соединений О. в низших степенях окисления; окислитель в орг. синтезе,
катализатор в р-циях гидроксилирования; благодаря легкости восстановления OsO4
орг. соединениями до OsO2 или до Os разб. водные р-ры OsO4
используют для окраски биол. препаратов; токсичен, действует на слизистые оболочки
глаз, носа и рта, ПДК 0,002 мг/м3.
Диоксид OsO2
известен в трех формах: черный OsO2, пирофорный, получают обезвоживанием
дигидрата при 125°С; черный реакционноспособный OsO2 образуется
при обезвоживании OsO2·2H2O при 200 °С; коричневая
форма, нерастворимая в к-тах и щелочах, получается при т-ре выше 400 °С.
Коричневый OsO2-кристаллы тетрагон. сингонии (а = 0,450 нм,
с = 0,319 нм); 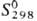 71 Дж/моль · К); получают термич. диссоциацией осмата калия K[OsO3N],
прокаливанием смеси K2[OsCl6] и Na2CO3,
электролизом р-ра OsO4 в р-ре КОН, восстановлением OsO4
гремучим газом, взаимодействием О. с OsO4.
71 Дж/моль · К); получают термич. диссоциацией осмата калия K[OsO3N],
прокаливанием смеси K2[OsCl6] и Na2CO3,
электролизом р-ра OsO4 в р-ре КОН, восстановлением OsO4
гремучим газом, взаимодействием О. с OsO4.
В газовой фазе существуют
монооксид OsO [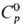 31,8 Дж/моль·К),
31,8 Дж/моль·К), 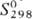 254 Дж/моль·К)] и триоксид OsO3 (
254 Дж/моль·К)] и триоксид OsO3 (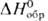 -280 кДж/моль).
-280 кДж/моль).
Дисульфид OsS2
(минерал эрлихманит) не раств. в воде, слабых к-тах и р-рах щелочей, конц. HNO3,
H2O2, НСlO4, разлагается царской водкой; получают
из простых в-в при 600 °С в вакууме, взаимод. H2S с К2
[OsCl6]; промежут продукт при пиро- и гидрометаллургич. получении
О.
Гексафторид OsF6
гидролизуется водой; получают из простых в-в при 250-300 С; применяют для легирования
осмием W, получаемого восстановлением WF6. Тетрахлорид OsCl4
гигроскопичен, гидролизуется водой и соляной к-той; получают из простых в-в
при 650-700 СС.
Получение. Сырьевые источники
О.-сульфидные медно-никелевые и медно-молибденовые платиносодержащие руды [содержание
О. составляет (0,7-0,9)-10 -4 % по массе]. Один из крупнейших поставщиков
О.- ЮАР. О. и др. платиноиды концентрируются в шламах электролитич. рафинирования
Сu и Ni. Из шламов получают концентрат платиновых металлов, содержащий 0,1%
О. по массе. Для выделения О. концентрат прокаливают на воздухе при 800-900
°С. Газовая фаза, содержащая OsO4, SO2 и SeO2,
поглощается 10%-ным р-ром NaOH. Р-р нейтрализуют до рН 8 и затем действием SO2
получают осадок (2-3% О. по массе), содержащий Na8[Os(SO3)6].
Осадок обрабатывают H2SO4 для удаления SO2,
а затем окислителем (напр., Сl2 в присут. NaOH). Образовавшийся OsO4
отгоняют, поглощая его пары 20%-ным р-ром щелочи (содержание О. в р-ре ~ 60
г/л). Этот р-р обрабатывают метанолом для восстановления образовавшегося перосмата
до осмата, а затем насыщ. р-ром КОН и осаждают K2[OsO2(OH)4].
Полученную соль восстанавливают Н2 в автоклаве в присут. соляной
к-ты при 120°С и получают металлический О. в виде губки. Осмиевую губку
сушат при 90 °С в атмосфере Н2, затем прокаливают при 930 °С
и измельчают в тонкий порошок (содержание О. 99,98%, примеси-Fe, Ni, Si).
По др. схеме щелочной р-р
OsO4 обрабатывают NH4Cl и получают соль Фреми [OsO2(NH4)4]
Сl2. Ее сушат, прокаливают в атмосфере Н2 при 700-800
°С и получают О. в виде губки, к-рую затем измельчают и обрабатывают для
удаления примесей фтористоводородной к-той. Получают О. 99,95%-ной чистоты.
Применение. О.-компонент
сверхтвердых и износостойких сплавов с Ir (опорные штифты, вращающиеся оси точных
приборов, прецизионные малые контакты и др.), с Ir и Ru (шарики перьев авторучек),
с W и Мо (катоды термоионных диодов), с Pd (электрич. контакты); компонент композиц.
материала (F Co-Ni, электрич. контакты).
О. открыл С. Теннант в
1804.
Лит. Металлургия
осмия. А.-А., 1981 См. также лит при ст. Платиновые
металлы. A.M. Орлов
===
Исп. литература для статьи «ОСМИЙ»: нет данных
Страница «ОСМИЙ» подготовлена по материалам химической энциклопедии.
|

