|
НИТРИЛЫ, орг. соед.,
содержащие одну или неск. циано-групп —C=N, связанных с орг. радикалом.
Изомерны изонитрилам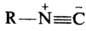 . .
Атомы С и N в цианогруппе
имеют sp-гибридизацию; длины связей, напр. для CH3CN, 0,1468
нм (С—С) и 0,116 нм (C=N); средняя энергия связи C=N 672 кДж/моль.
Обладает отрицат. индукционным и мезо-мерным эффектами (индукц. константа Тафта
s* 3,6; константы Гаммета sм 0,56; sn 0,66; sn-
1,00; s+ 0,659).
Названия Н. обычно производят
от назв. соответствующей карбоновой к-ты, напр. СН3СК-ацетонитрил
(нитрил уксусной к-ты), КС(СН2)4СН-адиподинитрил. Часто
Н. рассматривают как производные синильной к-ты - цианиды (напр., СН2=СНСН2СМ-аллилцианид)
или цианозамещен-ные углеводороды (напр., НС(СN)3-трицианометан).
Физические свойства.
Н.-бесцв. жидкости или твердые в-ва. Физ. свойства нек-рых важнейших Н.
приведены в таблице.
ФИЗИЧЕСКИЕ СВОЙСТВА
НЕКОТОРЫХ НИТРИЛОВ
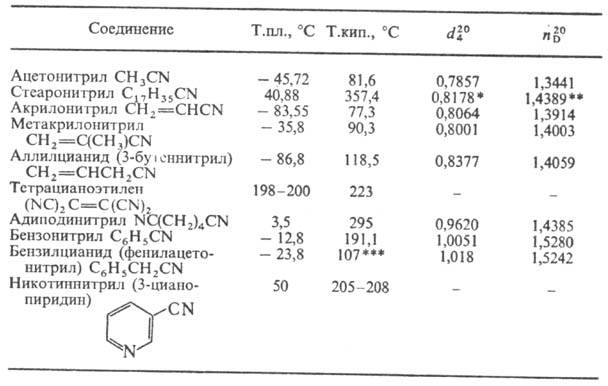
* При 41 °С. **
При 45 °С. *** При 12 мм рт.ст.
Н. плохо раств. в воде
(за исключением низших алифатических Н.), хорошо раств. во многих орг. р-рителях.
В ИК спектрах Н. и спектрах
комбинац. рассеяния присутствует характеристич. полоса при 2220-2270 см-1.
Химические свойства.
Электронное строение Н. может быть представлено с помощью резонансных структур:
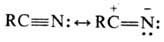
В соответствии с этим Н.
вступают в р-ции с электрофилами (по атому N) и нуклеофилами (по атому С). Они
также образуют комплексы с солями металлов (напр., CuCl, NiCl2, SbCl5
и др.) с участием неподеленной пары электронов атома N. Благодаря ненасыщенности
и легкой поляризуемости
цианогруппа активирует связанный с ней орг. радикал, напр. облегчает диссоциацию
связи С—Н у a-углерод-ного атома, а благодаря незначит. стерич. эффекту обеспечивает
легкость р-ций присоединения по связи C=N.
В апротонной среде при
низкой т-ре Н. реагируют с галогеноводородами, образуя нитрилиевые соли (ф-ла
I) и соли имидоилгалогенидов(II):
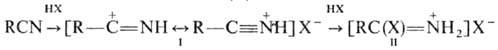
Через образование нитрилиевых
солей проходит гидратация Н. в кислой среде до амидов и далее гидролиз до карбоновых
к-т:
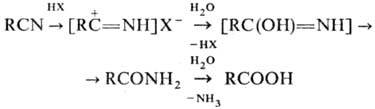
Амиды образуются также
при гидратации Н. в щелочной среде (послед. гидролиз амидов приводит к солям
соответствующих карбоновых к-т) и при действии на Н. Н2О2
(Рад-зишевского реакция):
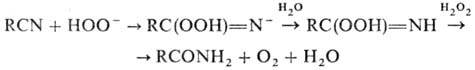
Р-ции Н. со спиртами в
присут. кислого катализатора -метод синтеза гидрогалогенидов имидоэфиров (см.
Пиннера реакции); гидролиз последних приводит к сложным эфирам:
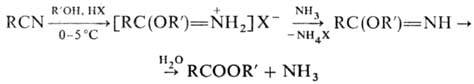
При замене спирта на тиол
R'SH образуются соли тио-имидатов 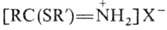 и эфиры тиокарбоновых к-т RC(O)SR'.
и эфиры тиокарбоновых к-т RC(O)SR'.
Обработка Н. H2S
позволяет получать с хорошим выходом тиоамиды RC(S)NH2.
При нагревании Н. с карбоновыми
к-тами R'COOH образуются имиды RCONHCOR'. Иногда имеет место миграция цианогруппы
(перенитрилирование):
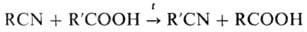
При действии галогеноводородов
(НСl или НВr) на смесь Н. с карбоновыми к-тами получают гидрогалогениды амидов,
а также ангидриды или галогенангидриды карбоновых к-т:
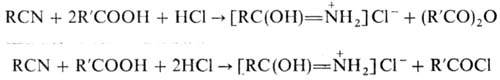
Р-ция Н. с аммиаком, первичными
или вторичными аминами приводит к амидинам RC(NHR')=NH, с гидроксил-амином-к
амидоксимам RC(NH2)=NOH, с гидразоном-к амидразонам RC(NH2)=NNH2.
При взаимодействии Н. с
фенолами и НСl образуются соли кетиминов, при гидролизе превращающиеся в соответствующие
гидроксикетоны (Хеша реакция):
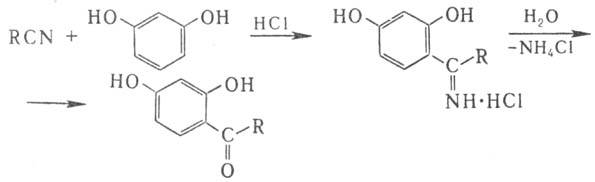
Взаимодействие Н. с магнийорг.
соед. приводит к N-маг-нийзамещенным кетиминам, при кислотном гидролизе к-рых
образуются кетоны. Если орг. радикал в молекуле Н. обладает электроноакцепторными
св-вами или пространственно затрудняет присоединение R'MgX по связи C=N,
имеет место р-ция обмена:
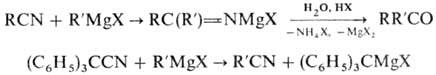
Присоединением к Н. РСl5
получают фосфазосоединения (иминофосфораны). Аналогично присоединяются к Н.
че-тырехфтористая сера, тетрафторгидразин и фторид хлора, напр.: .
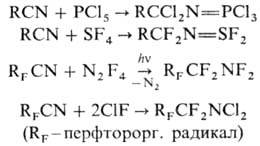
Н. реагируют с олефинами
и их функцией, производными (ненасыщ. к-ты, их эфиры и др.) в присут. кислотного
катализатора, образуя замещенные амиды (Риттера реакция); вступают в
р-цию Дильса - Альдера, напр.:
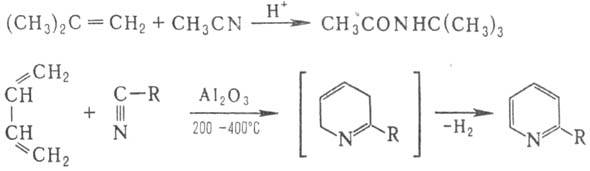
При использовании в качестве
диенофила перфторалкил-цианидов RFCN или дициана р-ция циклоприсоединения
идет без катализатора с количеств. выходом.
При действии на Н. азотистоводородной
к-ты образуются тетразолы:
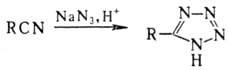
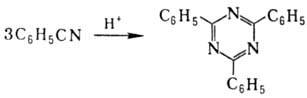
Ароматические H., а также
H., содержащие в орг. радикале электроноакцепторные группы, в присут. кислотных
катализаторов превращ. в сим-триазины, напр.:
В присут. оснований Н.
димеризуются с образованием иминонитрилов (или енаминонитрилов) (Торпа-Циглера
реакция). Из динитрилов с помощью этой р-ции получают циклич. кетоны:
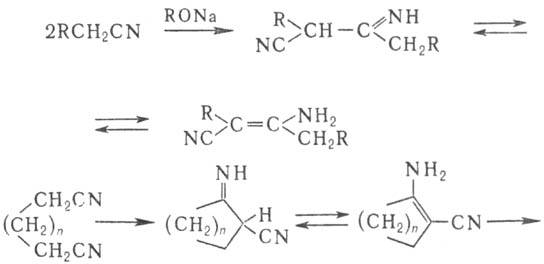
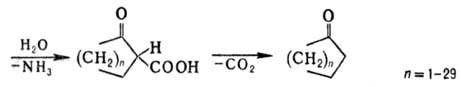
Одна из важнейших р-ций
Н.-восстановление, протекающее ступенчато через промежут. образование альдиминов:
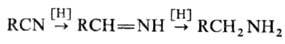
Для восстановления Н. до
аминов наиб. часто применяют каталитич. гидрирование на Pt или Pd при давлении
0,1-0,3 МПа и 20-50 °С или на Ni или Со при 10-25 МПа и 100-200 °С.
Для подавления образования вторичных и третичных аминов добавляют NH3.
В качестве восстановителей используют также металлич. Na в этаноле, комплексные
гидриды металлов и бора, напр. LiAlH4 , NaBH4 и др. При
восстановлении Н. SnCl2 в присут. НСl образуются соли альдиминов,
гидролиз к-рых приводит к альдегидам (Сте-фена реакция):
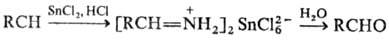
При использовании диалкилалюминийгидридов
Alk2AlH, а также при каталитич. восстановлении Н. на Ni-Ренея в присут.
гипофосфита натрия в водной СН3СООН или в смеси СН3СООН
с пиридином можно остановить восстановление Н. на стадии образования альдимина.
Напротив, в жестких условиях, напр. при 250-300 °С на смеси оксидов Сu и
Ni, протекает гидрогенолиз Н.:
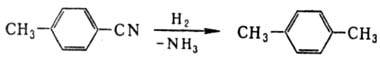
Электролитич. восстановление
Н. на катодах с высоким перенапряжением водорода или на Ni-Ренея, удерживаемом
в магн. поле, обеспечивает высокую селективность восстановления до первичных
аминов с выходом более 80%.
К важнейшим р-циям Н. по
орг. радикалу относят: взаимод. с карбонильными соед. с образованием цианооле-финов
(см. Кнёвенагеля реакция), присоединение разл. нуклеофилов к а,р-ненасыщенным
Н., напр. к акрилонит-рилу, и полимеризацию (см. Полиакрилонитрил):
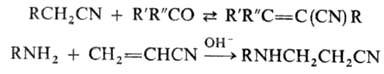
Основные методы получения.
1) Дегидратация амидов RCONH2, аммониевых солей карбоновых к-т
RCOONH4 или альдоксимов RCH=NOH (см. Бекмана перегруппировка)при нагр. с Р2О5, РСl5, РОСl3
или SOCl2. В пром-сти р-цию обычно проводят в присут. катализаторов
дегидратации (Н3РО4 и ее соли) в атмосфере NH3
, напр.:
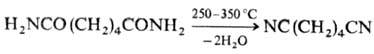
2) Алкилирование солей
синильной к-ты:
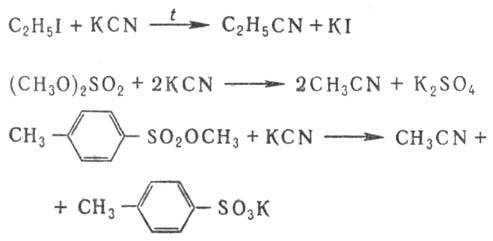
При алкилировании алкил-
и аралкилгалогенидами широко применяют межфазный катализ, напр. при пром. получении
бензилцианида.
Ароматические Н. получают
взаимод. арилгалогенидов с CuCN или сплавлением солей сульфокислот с NaCN, напр.:
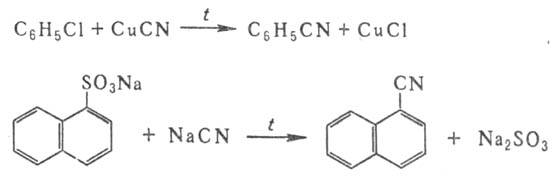
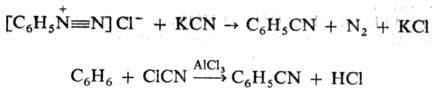
Используют также
р-цию солей диазония с цианидами К или Си (см. Зандмейера реакция), взаимод.
ароматич. углеводородов с хлорцианом или трихлорацетонитрилом в присут. АlСl3:
3) Присоединение HCN по
кратным связям (используют для получения промышленно важных Н.), напр.:
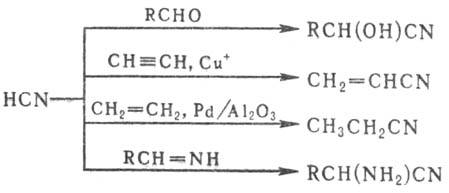
Циангидрины получают присоединением
HCN к карбонильным соед. или эпоксидам в присут. оснований (см. Оксинитрилы).
4) Совместное окисление
углеводородов и NH3 кислородом воздуха при 400-500 °С в присут.
молибдатов и фосфо-молибдатов Bi, молибдатов и вольфраматов Те и Се и др. катализаторов
(см. Окислительный аммонолиз):
Для окисления м. б. использованы
спирты и альдегиды, напр.:
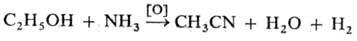
Н. образуются также при
действии окислителей на амины:
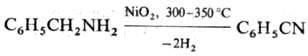
5) Теломеризация олефинов
с галогеноцианидами или р-ция последних с магнийорг. соед.:
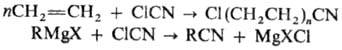
Анализ и применение.
Для анализа Н. используют физ.-хим. методы, восстановление Н. на капельном
ртутном электроде позволяющее определять их в концентрации до 10-3-10-5
%, а также хим. методы, напр. щелочной гидролиз Н. с послед. количеств. определением
NH3.
Применяют Н. в качестве
р-рителей, инициаторов радикально-цепной полимеризации и теломеризации, сырья
в произ-ве волокнообразующих полимеров и смол (см. По-лиакрилонитрильные
волокна, Полиамидные волокна), пластификаторов, лек. в-в и пестицидов.
Н. ядовиты и при работе
требуют мер предосторожности (ср-ва индивидуальной защиты, приточно-вытяжная
вентиляция). Н. или их отходы уничтожают щелочным гидролизом или при действии
окислителей (р-ры Н2О2 или КМnО4). Механизм
токсич. действия Н. связан с их способностью нарушать ф-цию фермента цитохромоксидазы,
подавляя процесс переноса кислорода из крови к клеткам организма. Отравление
может произойти при вдыхании паров Н., при попадании их в желудочно-кишечный
тракт или через кожу. Противоядия-амилнитрит, Na2S2O3,
глюкоза (см. Синильная кислота).
Объем произ-ва важнейших
Н. приближается к 5 млн. т/год. См. также Акрилонитрил, Адиподинитрил, Ацетонит-рил,
Бензонитрил и др.
===
Исп. литература для статьи «НИТРИЛЫ»: Бобков С.
С., Смирнов С. К., Синильная кислота, М., 1970; Зильберман Е. Н., Реакции нитрилов,
М., 1972; Общая органическая химия, пер. с англ., т. 3, М., 1982; Kirk-Othmer
encyclopedia, 3 ed., v. 15, N.Y., 1981.
С. К. Смирнов.
Страница «НИТРИЛЫ» подготовлена по материалам химической энциклопедии.
|

