|
АММИАК (от греч. hals ammoniakos, букв. - амонова соль; так назывался
нашатырь, к-рый получали близ храма бога Амона в Египте) NH3,
бесцв. газ с резким запахом. Молекула имеет форму правильной пирамиды (см.
рис. 1). Связи N— Н полярны;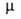 4,85*10-30
Кл*м (0-150°С); энергия связи N—Н 389,4 кДж/моль. Поляризуемость молекулы
22,6*10-25 см3. У атома N имеется неподеленная пара
электронов, к-рая обусловливает способность А. к образованию донорно-акцепторной
и водородной связей. Существование водородных связей и значительная полярность
молекул А. - причины сильного взаимодействия между ними, вследствие чего
физические свойства А. во многом аномальны по сравнению со св-вами однотипных
соединений (РН3, SbH3, AsH3). Для NH3
т. пл. -77,7°С, т. кип. -33,35°С; dt4 0,790
(-40°С), 0,681 (-33,35°С), 0,639 (0°С), 0580 (40 °С); tкрит
133°С, pкрит 11,425 кПа, dкрит 0,235 г/см3; 4,85*10-30
Кл*м (0-150°С); энергия связи N—Н 389,4 кДж/моль. Поляризуемость молекулы
22,6*10-25 см3. У атома N имеется неподеленная пара
электронов, к-рая обусловливает способность А. к образованию донорно-акцепторной
и водородной связей. Существование водородных связей и значительная полярность
молекул А. - причины сильного взаимодействия между ними, вследствие чего
физические свойства А. во многом аномальны по сравнению со св-вами однотипных
соединений (РН3, SbH3, AsH3). Для NH3
т. пл. -77,7°С, т. кип. -33,35°С; dt4 0,790
(-40°С), 0,681 (-33,35°С), 0,639 (0°С), 0580 (40 °С); tкрит
133°С, pкрит 11,425 кПа, dкрит 0,235 г/см3;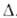 Н°исп
23,27 кДж/моль, Н°исп
23,27 кДж/моль,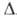 Н°пл,
5,86 кДж/моль; для газа Ср° 35,63 Дж/(моль*К), Н°пл,
5,86 кДж/моль; для газа Ср° 35,63 Дж/(моль*К),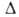 Ноo6p
-45,94
кДж/моль, S°298 192,66 ДжДмоль*К). Ноo6p
-45,94
кДж/моль, S°298 192,66 ДжДмоль*К).
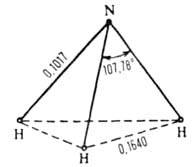
Рис. 1. Структура молекулы NH3 (длина связи - в нм).
Твердый А. - бесцв. кристаллы с кубич. решеткой (а = = 0,515
нм, 2 = 4, пространств, группа Р213). В жидком А. молекулы
ассоциированы вплоть до критич. т-ры, электролитич. диссоциация совершенно
ничтожна, произведение концентраций [NH;][NH2] составляет 10-22
(-33,4°С);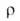 8*106 Ом*см;
8*106 Ом*см;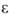 25,4
( - 77 оС). Жидкий А. растворяет щелочные и щел.-зем. металлы,
Al, Eu, Yb, P, S, I, мн. интерметаллиды и др. Р-ры металлов в жидком А.
имеют металлич. проводимость, поскольку содержат ионы металла и сольватированные
электроны; они являются сильнейшими восстановителями. Растворенные в А.
соед. с полярной ковалентной или ионной связью диссоциируют на ионы. В
жидком А. многие в-ва способны отщеплять протон, кислотные св-ва проявляют
в нем даже углеводы, амиды к-т, нек-рые углеводороды. 25,4
( - 77 оС). Жидкий А. растворяет щелочные и щел.-зем. металлы,
Al, Eu, Yb, P, S, I, мн. интерметаллиды и др. Р-ры металлов в жидком А.
имеют металлич. проводимость, поскольку содержат ионы металла и сольватированные
электроны; они являются сильнейшими восстановителями. Растворенные в А.
соед. с полярной ковалентной или ионной связью диссоциируют на ионы. В
жидком А. многие в-ва способны отщеплять протон, кислотные св-ва проявляют
в нем даже углеводы, амиды к-т, нек-рые углеводороды.
Р-римость А. в воде (% по массе): 42,8 (0°С, 33,1 (20°С), 23,4 (40°С),
14,1 (60°С). Плотность водных р-ров (г/см3): 0,970 (8% по массе
NH3), 0,947 (16%), 0,889 (32%), 0,832 (50%), 0,733 (75%). Для
бесконечно разб. водного р-ра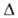 Норастворения
133,26 кДж/моль. А. хорошо раств. (но хуже, чем в воде) в спирте, ацетоне,
хлороформе, бензоле и др. орг. р-рителях. Образует гидраты с двумя (т.
пл. ок. - 90 °С), одной ( - 79 °С) и 0,5 ( - 78,2 °С) молекулами воды. Норастворения
133,26 кДж/моль. А. хорошо раств. (но хуже, чем в воде) в спирте, ацетоне,
хлороформе, бензоле и др. орг. р-рителях. Образует гидраты с двумя (т.
пл. ок. - 90 °С), одной ( - 79 °С) и 0,5 ( - 78,2 °С) молекулами воды.
В системе NH3—Н2О установлено существование эвтек-тик:
лед + NН3*Н2О (33,23% по массе NH3, т.
пл. -100,3оС), NH3*H2O + NH3*0,5H2O
(55,11%, -83,3°С), NH3*H2O + NH3 (80,05%,
- 92,5°С). В водном р-ре А. частично ионизирован на NH4+
и ОН , что обусловливает щелочную р-цию р-ра (рКа 9,247).
Разложение А. на водород и азот становится заметным выше 1200-1300 °С,
в присут. катализаторов - выше 400°С. А. весьма реакционноспособен. Для
него типичны р-ции присоединения, в частности протона при взаимод. с к-тами.
В результате образуются соли аммония, к-рые по многим св-вам подобны солям
щелочных металлов.
А. - основание Льюиса, присоединяет не только Н+ , но и др.
акцепторы электронов, напр. BF3 с образованием BF3*NH3.
Дает аммины при взаимод. с солями. Щелочные и щел.-зем. металлы
реагируют с жидким и газообразным А., давая амиды. При нагр. в атмосфере
А. многие металлы и неметаллы (Zn, Cd, Fe, Cr, B, Si и др.) образуют нитриды.
Жидкий А. взаимод. с серой по р-ции: 10S + 4NH3 -> 6H2S
+ N4S4. Ок. 1000°С А. реагирует с углем, образуя
HCN и частично разлагаясь на N2 и Н2. Большое практич.
значение имеет р-ция А. с СО2, ведущая к образованию карбамата
аммония NH2COONH4, к-рый при 160-200 °С и давл. до
40 МПа распадается на воду и мочевину. Водород в А. может быть замещен
галогенами. А. горит в атмосфере О2, образуя воду и N2.
Каталитич. окислением А. получают NO промежут. продукт в произ-ве HNO3.
Каталитич. окисление А. в смеси с СН4 дает HCN. Такие сильные
окислители, как Н2О2, К2Сr2О7
и КМnО4, окисляют А. в водных р-рах. Газообразный А. окисляется
Вr2 и С12 до N2.
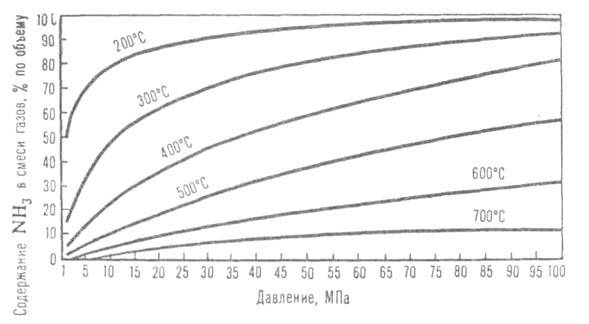
Рис. 2. Зависимость равновесного содержания NH3 в газовой
смеси (Н2: N2 = 3) от давления при разных т-рах.
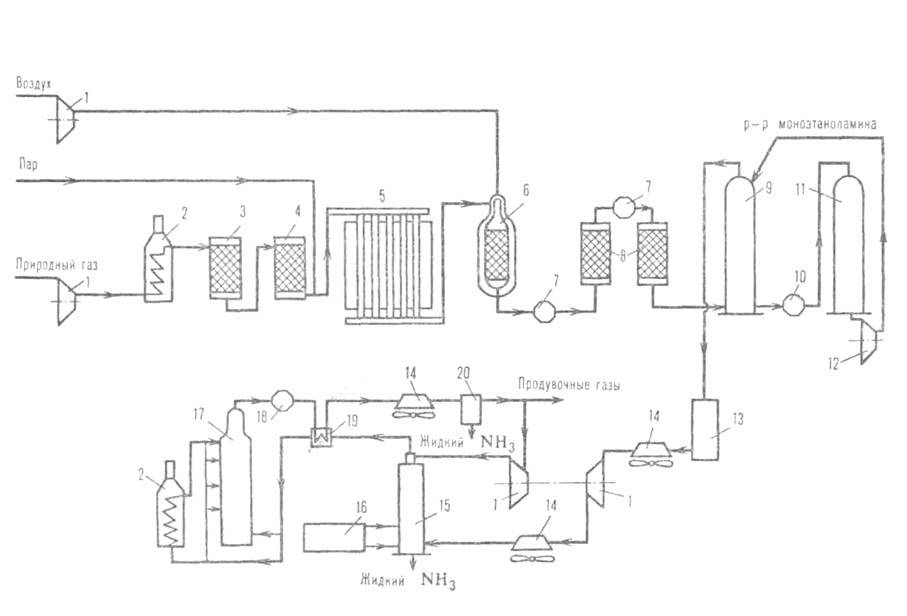
Рис. 3. Агрегат синтеза аммиака мощностью 1360 т/сут: 1-компрессоры;
2-подогреватели; 3-аппарат для тарирования сераорг. соед.; 4-адсорбер H2S;
5-трубчатая печь (первичный риформинг); 6-шахтный конвертор (вторичный
риформинг); 7-паровые котлы; 8-конверторы СО; 9-абсорбер СО2;
10-кипятильник; 11 -регенератор р-ра моноэтаноламина; 12-насос; 13-аппарат
для гидрирования остаточных СО и СО2; 14-воздушные холодильники;
15-конденсац. колонна; 16-испаритель жидкого NH3 (для охлаждения
газа и выделения NH3); 17-колонна синтеза NН3; 18-водоподогреватель;
19-теплообменник; 20-сепаратор.
Осн. пром. способ получения А. - по р-ции 1/2N2
+ 3/2H2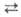 NH3.
Сдвигу равновесия вправо способствуют повышение давления и понижение т-ры
(см. рис. 2). Тепловой эффект р-ции при 29,4 МПа составляет 52,38 кДж/моль
при 500°С и 51,29 кДж/моль при 400°С (с учетом теплоты смешения газов).
Процесс проводят в присут. кат.- Fe, активированного К2О, А12О3,
СаО и др. Каталитич. яды - сернистые и кислородсодержащие соединения. Для
известных катализаторов скорость р-ции описывается ур-нием Темкина - Пыжева: NH3.
Сдвигу равновесия вправо способствуют повышение давления и понижение т-ры
(см. рис. 2). Тепловой эффект р-ции при 29,4 МПа составляет 52,38 кДж/моль
при 500°С и 51,29 кДж/моль при 400°С (с учетом теплоты смешения газов).
Процесс проводят в присут. кат.- Fe, активированного К2О, А12О3,
СаО и др. Каталитич. яды - сернистые и кислородсодержащие соединения. Для
известных катализаторов скорость р-ции описывается ур-нием Темкина - Пыжева:
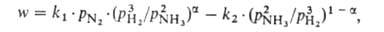
где w-наблюдаемая скорость процесса, равная разности скоростей
образования и разложения A., kl и k2-константы
скорости образования и разложения А., рH2 , pN2
и pNH3 -парциальное давление соответствующего газа,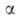 =0,5
для большинства пром. катализаторов. При давл. ~ 30 МПа и т-ре ~ 500 °С,
используемых на практике, равновесная концентрация А. в газовой смеси составляет
~ 30%. Однако равновесие на выходе из колонны синтеза, как правило, не
достигается, поскольку с целью увеличения производительности единицы объема
катализатора процесс проводят при высоких объемных скоростях ( ~ 15000
ч -1). Поэтому при однократном прохождении через массу катализатора
возможно превращ. в А. лишь 15-25% исходной газовой смеси. Для полного
превращ. необходима многократная циркуляция, к-рую осуществляют с помощью
компрессора. В цикл непрерывно вводят свежую газовую смесь взамен пошедшей
на образование А. Осн. сырье (~ 90%) для получения Н2 в произ-ве
А. - прир. газ, перерабатываемый в осн. методом двуступенчатой паровой
конверсии (см. Водород); незначит. долю (менее 10%) составляет коксовый
газ и электролитич. водород. Мощность установок по произ-ву А. из прир.
газа 200 и 420 тыс. т/год. Произ-во А. в агрегатах мощностью 1360 т/сут
осуществляется в одной технол. линии (см. рис. 3) и включает след. стадии:
1) очистку прир. газа от сернистых соед. каталитич. гидрированием их до
H2S с послед. его поглощением ZnO; 2) паровую конверсию прир.
газа под давл. 3,8 МПа при 860°С на катализаторе Ni-Al в трубчатой печи
(первичный риформинг); 3) паровоздушную конверсию остаточного метана в
шахтном конверторе (вторичный риформинг) при 990-1000°С и 3,3 МПа, на катализаторе
Ni-Al; на этом этапе водород обогащается азотом воздуха для получения смеси
состава Н2: N2 = 3, поступающей на синтез NH3;
4) конверсию СО до СО2 и Н2 сначала при 450°С и 3,1
МПа на катализаторе Fe-Cr, затем при 200-260°С и 3,0 МПа на катализаторе
Zn-Cr-Cu; 5) очистку Н2 от СО2 абсорбцией р-ром моноэтаноламина
или горячим р-ром К2СО3 при 2,8 МПа; 6) очистку газа
путем гидрирования от остаточных СО и СО2 в присут. Ni-Al при
280°С и 2,6 МПа; 7) компримирование очищенного газа до 30 МПа и синтез
А. на железном промотированном катализаторе при 420-500 °С. Реактор синтеза
А. представлен на рис. 4. =0,5
для большинства пром. катализаторов. При давл. ~ 30 МПа и т-ре ~ 500 °С,
используемых на практике, равновесная концентрация А. в газовой смеси составляет
~ 30%. Однако равновесие на выходе из колонны синтеза, как правило, не
достигается, поскольку с целью увеличения производительности единицы объема
катализатора процесс проводят при высоких объемных скоростях ( ~ 15000
ч -1). Поэтому при однократном прохождении через массу катализатора
возможно превращ. в А. лишь 15-25% исходной газовой смеси. Для полного
превращ. необходима многократная циркуляция, к-рую осуществляют с помощью
компрессора. В цикл непрерывно вводят свежую газовую смесь взамен пошедшей
на образование А. Осн. сырье (~ 90%) для получения Н2 в произ-ве
А. - прир. газ, перерабатываемый в осн. методом двуступенчатой паровой
конверсии (см. Водород); незначит. долю (менее 10%) составляет коксовый
газ и электролитич. водород. Мощность установок по произ-ву А. из прир.
газа 200 и 420 тыс. т/год. Произ-во А. в агрегатах мощностью 1360 т/сут
осуществляется в одной технол. линии (см. рис. 3) и включает след. стадии:
1) очистку прир. газа от сернистых соед. каталитич. гидрированием их до
H2S с послед. его поглощением ZnO; 2) паровую конверсию прир.
газа под давл. 3,8 МПа при 860°С на катализаторе Ni-Al в трубчатой печи
(первичный риформинг); 3) паровоздушную конверсию остаточного метана в
шахтном конверторе (вторичный риформинг) при 990-1000°С и 3,3 МПа, на катализаторе
Ni-Al; на этом этапе водород обогащается азотом воздуха для получения смеси
состава Н2: N2 = 3, поступающей на синтез NH3;
4) конверсию СО до СО2 и Н2 сначала при 450°С и 3,1
МПа на катализаторе Fe-Cr, затем при 200-260°С и 3,0 МПа на катализаторе
Zn-Cr-Cu; 5) очистку Н2 от СО2 абсорбцией р-ром моноэтаноламина
или горячим р-ром К2СО3 при 2,8 МПа; 6) очистку газа
путем гидрирования от остаточных СО и СО2 в присут. Ni-Al при
280°С и 2,6 МПа; 7) компримирование очищенного газа до 30 МПа и синтез
А. на железном промотированном катализаторе при 420-500 °С. Реактор синтеза
А. представлен на рис. 4.
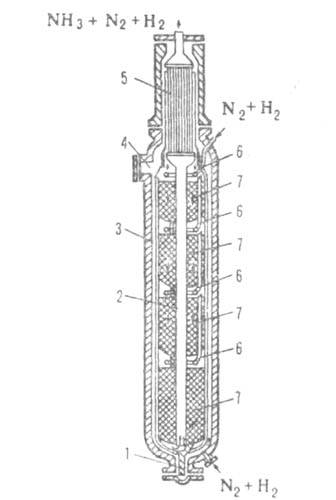
Рис. 4. Колонна синтеза аммиака: 1-люк для выгрузки катализатора;
2-центр, труба; 3-корпус; 4-люк для загрузки катализатора; 5 -теплообменник;
6-трубы для ввода холодного газа; 7 - катализатор.
А. выпускается в жидком виде либо в виде водного р-ра-аммиачной воды,
чаще
всего с содержанием 25% NH3. А., поставляемый на нужды пром-сти,
содержит не менее 99,96% по массе NH3, до 0,04% Н2О,
до 2 мг/л машинного масла, до 1,0 мг/л Fe. В техн. А., транспортируемый
по трубопроводу, добавляется до 0,2-0,4% Н2О для ингибирования
коррозии стали. А. обнаруживается по характерному запаху. Бумажка, смоченная
р-ром Hg2(NO3)2, при действии А. чернеет.
Малые кол-ва А. в водных р-рах открывают с помощью реактива Несслера. Количественно
А. определяют титриметрически.
Применяют А. в произ-ве HNO3, мочевины, NH4NO3,
(NH4)2CO3, (NH4)2SO4
и др., аммофоса, уротропина, как жидкое удобрение, в кач-ве хладагента.
Мировое произ-во А. составило в 1982 ок. 89 млн. т, в т.ч. в СССР 17,76,
США 14.06, СРР 3,14, Франции 1,9, Японии 2,01, ФРГ 1,92 млн. т.
Жидкий А. хранят при 2,0 МПа или при атм. давлении и — 33°С. Перевозят
в стальных баллонах (окрашены в желтый цвет, имеют надпись "Аммиак" черного
цвета), железнодорожных и автомобильных цистернах, по воде - в спец. танкерах,
транспортируют также по трубопроводам. При содержании в воздухе 0,5% по
объему А. сильно раздражает слизистые оболочки. При остром отравлении поражаются
глаза и дыхат. пути, при хронич. отравлениях наблюдаются расстройство пищеварения,
катар верх. дыхат. путей, ослабление слуха. Жидкий А. вызывает сильные
ожоги кожи. ПДК 20 мг/м3. Смесь А. с воздухом взрывоопасна,
КПВ 15-28%; для воздушно-аммиачных смесей, содержащих 9-57% по объему А.,
т. всп. ок. 1000°С. Чистый А. был получен Дж. Пристли в 1774.
===
Исп. литература для статьи «АММИАК»: Малина И. К., Развитие исследований в области синтеза аммиака,
М., 1973; Алексеев А. М. [и др.], "Ж. Всес. хим. о-ва им. Д.И.Менделеева",
1978, т. 23, [№] 1, с 31-38; Синтез аммиака, М., 1982; Жаворонков Н. М.,
Овчаренко Б. Г., Охотский С. М., в кн.: Развитие химической промышленности
в СССР, т. 2, М., 1984, с. 7-37. См. также лит. при ст. Азот. Н.М. Жаворонков,
Л. Д. Кузнецов.
Страница «АММИАК» подготовлена по материалам химической энциклопедии.
|

