КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, содержат связь Si—С Иногда к К. с. относят все орг. в-ва, содержащие Si, напр. зфиры кремниевых к-т.
Классификация и номенклатура. К. с. подразделяют на "мономерныe", содержащие один или неск. атомов Si, к-рые рассматриваются в настоящей статье, и кремнийорганические полимеры. наиб. изучены след. группы К. с.: органогалогeпсиланы RnSiHal4-n (n=1-3) и RnSiHmHal4-n-m (n и m = 1,2; m+n=2,3); алкоксисиланы и ароксисиланы Si(OR)4, R'nSi(OR)4-n; органогидросиланы RnSiH4-n; органоаминосиланы RnSi(NR'2)4-n; органосиланолы RnSi(OH)4-nI; органоацилоксисиланы RnSi(OCOR')4-n (n=1-3); силатраны и др.; соед. с нeск. атомами Si - органосилоксаны со связями Si—О—Si, органосилазаны со связями Si—N—Si, органосилатианы (Si—S—Si), полиорганосиланы (Si—Si) и др. Большую группу составляют карбофункциональные К. с., из к-рых наиб. исследованы в-ва, содержащие в орг. радикале атомы галогена, амино-, гидрокси-, алкокси-, эпокси-группу и т. д.; соeд., содержащие группировку SiM, SiOM или SiRM (М - атом металла или неметалла, напр. Li, Na, К, В, Al, Sn, Ti, P, Fe), - т. наз. кремнийэлемeнтоорганические соединения; а также гетероциклич. К. с., содержащие один или более атомов Si в цикле, напр. силациклобутан, 10,10-дихлор-9-окса-10-сила-9,10-дигидрофенантрен ("оксафен") и др.
По номенклатуре ИЮПАК, соед. с одним атомом Si рассматривают как производные силана SiH4, указывая в наш. все связанные с атомом Si заместители, кроме атомов Н, напр. (CH3)2SillCl-диметилхлорсилан, CF3CH2CH2SiCl3-3,3,3-трифторпропилтрихлорсилан. Часто за основу берут назв. орг. соед., добавляя назв. соответствующего кремнийсодержащего заместителя, напр. Cl2(CH3)SiCH2Si(CH3)Cl2-биc-(метилдихлорсилил) метан.
Физические свойства. Замещение атома водорода у атома Si на др. атомы, орг. и неорг. группы увеличивает т-ры кипения К. с., изменяет в широком диапазоне и др. их св-ва (см. табл.). Для К. с. характерно понижение т-р плавления и кипения при переходе от производных дисилана к соответствующим производным дисилоксана, несмотря на увеличение мол. м., что является следствием низкого межмол. взаимод. последних. Большинство К. с. раств. в орг. р-ри гелях. Нек-рые К. с., содержащие гидрофильные группы (напр., [НО(СН3)2Si]2О, (C2H5O)3Si(CH2)3NH2 и др.), раств. в воде. Органосиланы, органосилоксаны-диэлектрики с высоким уд. объемным сопротивлением 1.1014-1.1016 Ом.см, элсктрич. прочностью 20-200 кВ/мм и tgd 0,01-0,001.
В И К спектрах К. с. полосы поглощения, обусловленные крeмнийсодержащими фрагментами, примерно в пять раз более интенсивны, чем полосы соответствующих углеродных аналогов. И К спектры характеризуются след. полосами поглощения (в см-1): 2250-2150 (SiH), 1250 (Si—CH3), 1630, 1125 (Si-C6H5), 3700-3650, 3400-3200 (Si-OH своб.), 1100-1000 (Si—О—Si), 800-670 (Si—Cl).
В отличие от соед. углерода, для спектров ЯМР К. с. характерна нелинейная зависимость величины хим. сдвига от числа однородных заместителей, связанных с центр. атомом Si.
Масс-спектры К. с, характеризуются наличием пиков молекулярных (квазимолекулярных) ионов и малым числом осколочных ионов. Важную роль играют разнообразные перегруппировочные процессы, напр. внутримол. диспропорционирование.
Химические свойства. Специфика хим. св-в К. с. в сравнении с соед. углерода обусловлена низкой электроотрицатсльностью атома Si и его способностью образовывать донорно-акцспторные связи с использованием одной или двух d-орбиталей. Координац. число атома Si может достигать 6. Атом Si имеет большую величину атомного радиуса (0,133 нм) в сравнении с атомным радиусом С (0,077 нм); для него не характерно образование двойных и тройных связей.
Большинство хим. превращ. К. с. основано на хим. инертности связей Si—С и высокой реакц. способности связей Si—Hal, Si—О, Si—N, Si—H, Si-O—H, Si—Si и т. п. и функц. групп в орг. заместителях у атома Si(R3SiCH2Cl, R3SiCH=CH2 и пр.). Прочность связи Si—С в значит. степени зависит от природы орг. заместителя и составляет (в кДж/моль): Si—С6Н5 310, Si-CH3 314, Si—С2Н5 260, Si—С3Н7 239, Si—С4Н9 218. Электроноакцепторные заместители у атома С, связанного с атомом Si, повышают устойчивость связи Si—С по отношению к электроф. реагентам и облегчают атаку нуклеоф. реагентами. Для К. с. характерно гетеролитич. расщепление связей Si с электроотрицат. заместителями, а в случае связей Si—H, Si—Si - как гетеролитич., так и гомолитич. расщепление.
Первичными продуктами гидролиза К. с., содержащих у атома Si реакдионноспособный заместитель, являются силанолы:
R3SiX + Н2O:R3SiOH+НХ X=Сl, OR', OCOR', NR'2, SR' и т.д.
Скорость гидролиза определяется природой заместителей у атома Si, pH среды, присутствием катализаторов. К. с., у к-рых X=Cl, OCH3, OCOCH3, NR2, SR гидролизуются уже влагой воздуха; в щелочной среде образуются силаноляты, напр.:
R3SiX+2NaOH:R3SiONa+Н2О
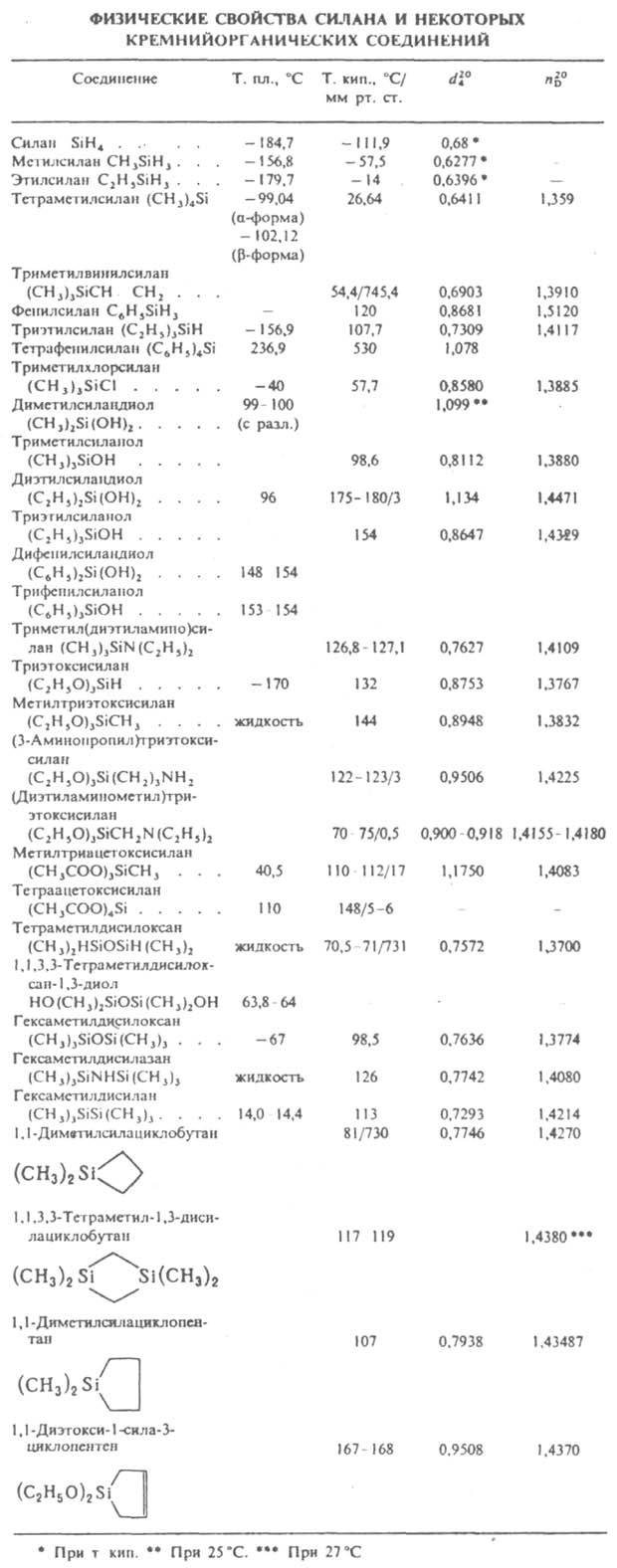
Во мн. технол. процессах силанолы - промежут. продукты, к-рые далее конденсируются с образованием силоксанов, напр.:
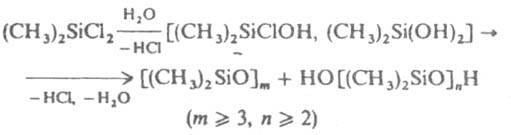
В связи с этим гидролиз К. с. часто наз. процессом "гидролитич. поликонденсации". К. с. со связями Si—H, Si—Si гидролизуются в щелочной среде до силоксанов с количеств. выделением водорода, напр.:
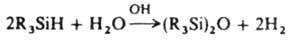
Объемные заместители у атома Si повышают гидролитич. стабильность К. с.
Легко гидролизующиеся К. с. вступают в протолитич. р-ции со спиртами, к-тами или аминами, напр.:
R3SiX+AlkOH:R3SiOAlk+НХ X=Cl, OR', OCOR', NR'2, SR' и др.
К протолитич. р-циям относятся также аммонолиз и аминолиз органогалогенсиланов:
R3SiCl+2R'2NH:R3SiNR'2+R'2NH HCl
К. с. со связями Si—H или Si—Si легко реагируют с галогенами, напр.:
R3SiH+X2:R3SiX+HX
X=Cl, Br, I R3SiSiR3+Br2:2R3SiBr
Способность активного атома водорода или металла в орг. соед. замещаться на триалкилсилильную группу используют для т. наз. силильной защиты, или силилирования (силилированием наз. также введение замещенной силильной группы в хим. соед.).
Для этой цели соед. обрабатывают (CH3)3SiX [X=Cl, N(C2H5)2, NHSi(CH3)3 и др.] или (C2H5)3SiH в присут.
катализаторов (PdCl2, NiCl2, основания и т. д.). При протолизе полученных триалкилсилильных производных водой, спиртом, водными р-рами к-т и оснований атом водорода регенерируется, напр.:
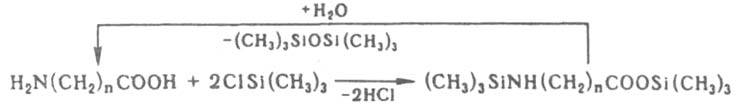
Временная замена подвижного атома Н на триалкилсилильную группу позволяет выделять, очищать и идентифицировать малолетучие и термически нестабильные орг. соед. К. с. способны к мeжмол. обмену заместителями в присут. катализаторов, напр. АlСl3 (р-ция диспропорционирования):
CH3SiCl3+(C6H5)2SiCl2DCH3(C6H5)SiCl2+C6H5SiCl3
Переэтерификация алкоксисиланов протекает в присут. к-т и оснований; при действии гидридов металлов хлор- и алкоксисиланы восстанавливаются, напр.:
(C6H5)2Si(OC2H5)2+2С6Н5ОН:(C6H5)2Si(OC6H5)2+2С2Н5ОН4(CH3)3SiCl+LiAlH4:4(CH3)3SiH+LiCl+АlСl3
К. с. вступают в р-ции конденсации. Конденсация триорганосиланолов и лиорганосиландиолов с выделением воды особенно легко протекает в присут. к-т и оснований: 2(CH3)3SiOH:(CH3)3SiOSi(CH3)3+Н2О. При увеличении числа гидроксильных групп у атома Si склонность к этой р-ции повышается. Алкоксисиланы конденсируются при т-рe выше 200 °С, образуя наряду с силоксанами простые эфиры (в случае мстокси- и этоксисиланов) или непредельные сосл. при трех и более атомах углерода в алкильной группе, напр.:
2R3SiOCH3:R3SiOSiR3+СН3ОСН3
Для К. с. характерна также гетeрофункцион. конденсация, напр. силанолов с хлорсиланами и силазанами:
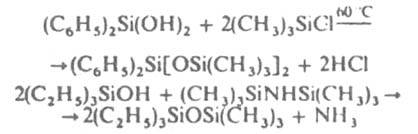
Алкоксисиланы конденсируются с силанолами при 20 С в присут. катализаторов (оловоорг. соед., амины и др.). аминоорганоэтоксисиланы - без катализатора. Органоизопропилидeнаминоксисиланы RnSi[ON=C(CH3)2]4-n и opнaноаминосиланы RnSi(NR'R:)4-n обладают повыш. реакц. способностью при конденсации с силанолами.
Конденсация силанолов с ацетокси-, алкоксисиланами и др. в присут. влаги воздуха положена в основу методов "холодной вулканизации" кремнийорг. композиц. материалов.
Алкоксисиланы вступают в гетерофункцион. конденсацию с. галоген- или ацетилоксисиланами в присут. электроф. катализаторов (НСl H2SO4, FeCl3 и др.), напр.:
R3SiOR'+XSiR3:R3SiOR3+R'X
R'=CH3, C2H5; X=Cl, CH3COO
Силанолы, силаноляты, алкокси- и ацилоксисиланы конденсируются также с хлоридами, алкоксидами, ацетатами металлов и неметаллов (В, Al, Ti, Sn, P и др.), напр.: 3(C2H5)3SiOH+ В(ОСН3)3:[(C,H5)3SiO]3B+ЗСН3ОН
4(CH3)3SiONa+TiCl4:[(CH3)3SiO]4Ti+4NaCl В описанных р-циях часто происходит обмен функц. групп с образованием побочных продуктов, напр.:
3R3SiOR'+(СН3СОО)3Аl:3R3SiOCOCH3+Al(OR')3
При термич. конденсации органохлорсиланов в газовой фазе или конденсации хлорсиланов с орг. соед. образуются кремнийорг. гетeроциклы, напр.:
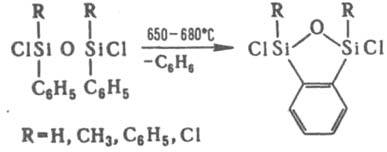
К р-циям конденсации можно отнести гидросилилирование - присоединение гидросиланов к непредельным соед., к-рое широко используется при синтезе К. с., а также при отверждении (вулканизации) кремнийорг. композиций ("р-ция полиприсоединения"), напр.:
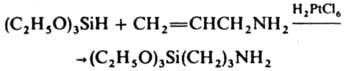
Группировки Si—О—Si в К. с. легко расщепляются протонными к-тами или к-тами Льюиса (H2SO4, HF, АlСl3, TiCl4, BF3, SiCl4), а также спиртами, алкоксисиланами, ангидридами и галогенангидридами к-т и т.д. В ряде случаев эти р-ции протекают каталитически, напр.:
(CH3)3SiOSi(CH3)3 + H2SО4 : [(CH3)3SiO]2SO2 + Н2О;
(C2H5)3SiOSi(C2H5)3 + AlI3 : 2(C2H5)3SiI + AlOI;
[(CH3)2SiO]3 + 6C4H9OH : 3(CH3)2Si(OC4H9)2 + 3H2O;
К. с., содержащие в алкильном радикале в b-положении к атому Si электроотрицат. заместитель, подвергаются т. наз. b-распаду, напр.:
R3SiCH2CH2Cl : R3SiCl + СН2=СН2
Биологическая активность. Разработано четыре типа биологически активных К. с.: 1) структурно-специфич. К. с., не имеющие орг. аналогов (силатраны, нек-рые комплексы метилсиликоната Na с гидроксикарбоновыми к-тами, 2,6-цис-дифенилгексаметилтетрациклосилоксан; последний применяется в медицине при лечении ряда заболеваний). Нек-рые силатраны стимулируют рост растений, дрожжевых грибов, насекомых, птиц, регенерацию соединит. ткани, шерсти, волос. 2) Кремнийорг. аналоги лек. ср-в, в к-рых один или более атомов С заменены на Si. Синтезированы К. с., проявляющие гипотензивное, спазмолитич., антигистаминное, курареподобное и др. виды физиол. действия. Биологически активные К. с. этого типа обычно менее токсичны, чем их углеродные аналоги, и быстрее разрушаются в организме. 3) Биологически активные орг. соед., модифицированные введением в их молекулу кремнийсодержащих групп. Такая модификация повышает активность и пролонгирует действие антибиотиков, стероидных гормонов и др. лек. ср-в, а также инсекторепеллентов; подавляет горький вкус ряда лечебных препаратов, уменьшает побочные р-ции простагландинов и фосфорорг. инсектицидов. 4) К. с., являющиеся донорами необходимого для организма Si (эфиры ортокремниевой к-ты, алкоксисилатраны).
Методы получения. Большинство К. с. синтезируют из хлорсиланов и органохлорсиланов, получаемых, в свою очередь, из элементного Si. Для произ-ва метил-, этил- и фенилхлорсиланов в пром-сти используют т. наз. прямой синтез-р-цию Si с СН3Сl, С2Н5Сl или С6Н5Сl в присут. Сu и др. инициаторов:
Si + CH3Cl : (CH3)2SiCl2 + (CH3)3SiCl + CH3SiCl3 + + CH3HSiCl2 + (CH3)2HSiCl + (CH3)4Si
В пром. масштабе органохлорсиланы получают также термич. газофазной конденсацией SiHCl3, CH3SiHCl2 и др. с С6Н3Сl или СН2=СНСl; термокаталитич. силилированием ароматич. соед. под давлением или термич. р-цией непредельных соед. с Si2Cl6, напр.:
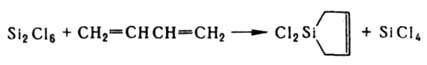
Пром. получение К. с., содержащих группировки SiOR, SiOCOCH3, SiOH, SiOSi и пр., основано, в первую очередь,
на соответствующих р-циях соед., содержащих связи Si—Сl, напр.:
R3SiCl + CH3COOH : R3SiOCOCH3 + HCl
Многие К. с. получают методами металлоорг. синтеза, используя орг. производные Mg, Li, Al, реже Na, Zn, Hg. В пром-сти магнийорг. синтез осуществляют в две стадии (получение реактива Гриньяра в среде орг. р-рителя и далее синтез К. с.) или одностадийно. В качестве кремнийсодержащего сырья используют SiCl4, Si(OC2H5)4, органохлор-, органоалкоксисиланы, напр.:
nRCl + nMg + Si(OC2H5)4 : RnSi(OC2H5)4_n + + nClMgOC2H5
Определение. Для идентификации К. с. определяют содержащийся в них Si методом эмиссионной или атомноабсорбц. спектроскопии, а также минерализацией до SiO2. Для количеств. определения содержания Si в К. с. используют метод "мокрого" (смесь H2SO4 с HNO3) или "сухого" сожжения (окисление Na2O2 под давлением). Кремний в образовавшемся SiO2 или кремниевой к-те определяют методами неорг. анализа.
Для идентификации функц. групп у атома Si используют качеств. р-ции. Группу SiOH определяют по обесцвечиванию реактива Фишера или по образованию осадка кремнезема при взаимод. с SiCl4; SiCl - пo образованию осадка AgCl при взаимод. с р-ром AgNO3; SiOR - по образованию оранжевой окраски с азотнокислым р-ром церийаммонийнитрата после обработки исследуемого К. с. щелочью; SiNH2, SiNHSi, SiNR2 - пo выделению NH3 или соответствующего амина после обработки К. с. соляной к-той, а затем КОН; SiH - пo изменению окраски р-ров Cu(II) от голубой к желтой или по выделению Н2 при р-ции со спиртовой щелочью. Последняя р-ция также используется для идентификации связи Si—Si.
Элементный анализ К. с. основан на их окислении при 1200-1300 °С (на новейших приборах - при 1860°С) с использованием Сr2О3.
Применение. Осн. применение мономерных К. с. - синтез кремнийорг. полимеров. Моно- и дифункциональные К. с. используют в произ-ве кремнийорганических жидкостей; дифункциональные - при получении кремнийорганических каучуков; ди-, три-, тетра- и полифункциональные - в произ-ве смол и лаков. К. с. применяют также в качестве гидрофобизаторов, антиадгезивов, аппретов для стекловолокна, текстильных и строительных материалов, наполнителей пластмасс, для модифицирования пов-стей сорбентов и др. материалов; получения покрытий для микроэлектронных устройств, спец. керамики; в качестве исходного сырья в синтезе катализаторов полимеризации олефинов, пестицидов, лек. ср-в и т.д., как сшивающие и модифицирующие агенты для разл. полимеров, в качестве теплоносителей (до 400 °С); тетраметилсилан - эталонное в-во в спектроскопии ЯМР.
Токсич. действие К. с. изменяется в широких пределах (ЛД50 от 0,1 до 5000 мг/кг и выше). Так ПДК триэтоксилана 1 мг/м3, тетраэтоксисилана 20 мг/м3, а фенилтриэтоксисилан не дает острых отравлений. Наличие аминогрупп в орг. заместителях К. с. усиливает общую токсичность и раздражающее действие, напр. ЛД50 (мыши, перорально) для диэтиламинометил- и (3-аминопропил)триэтоксисилана 7500 и 250 мг/кг соответственно. Для последнего ПДК 2,5 мг/м3. Особо высокой токсичностью обладают 1-арилсилатраны (ЛД50 0,1-1 мг/кг).
Мировое произ-во К. с. (без тетраэтоксисилана и этилсиликатов) в 1983 составило 300 тыс. т и, по прогнозу, к 2000 превысит 800 тыс. т.
===
Исп. литература для статьи «КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ»: Синтез кремнийорганических мономеров, М., 1961; Андрианов К. А., Методы элементоорганической химии. Кремний, М., 1968; Соболевский М. В., Музовская О. А., Попелева Г. С., Свойства и области применения кремнийорганических продуктов, М., 1975; Воронков М. Г., Зелчан Г. И., Лукевиц Э. Я., Кремний и жизнь, 2 изд., Рига, 1978; Хананашвили Л. М., Андрианов К. А., Технология элементоорганических мономеров и полимеров, 2 изд., М., 1983, с. 11-139, 376-400; Voorhoeve R.J.H., Organohalosilanes. Precursors to silicones, Amst. - N. Y. - L, 1967; Bazant V., Chvalovsky V., Rathousky J.,
Organosilicon compounds, v. 1-10, Prague, 1965-1983; Noll W., Chemk und Technologic der Silicone, 2 Аufl., Weinheim. 1968.
E. А. Чернышев, А. С. Шапатин.
Страница «КРЕМНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» подготовлена по материалам химической энциклопедии.
|

