|
АЛЬДЕГИДЫ [сокр. от новолат. al(cohol)dehyd(rogenatum) -алкоголь,
лишенный водорода], орг. соед., содержащие альдегидную группу СНО. По номенклатуре
ИЮПАК назв. А. производят прибавлением к назв. соответствующего углеводорода
суффикса "аль" или к назв. углеводорода, содержащего на один атом С меньше,
суффикса "карбальдегид"; в первом случае углерод альдегидной группы нумеруется
цифрой 1, во втором-альдегидная группа в нумерацию цепи не включается.
В полифункциональных соед. альдегидная группа обозначается приставкой "формил",
напр. соед. ОСНСН2СН (СНО)СН2СНО наз. 1,2,3-пропантрикарбальдегид
или 3-формилпентандиаль; нек-рые А. имеют тривиальные названия (см. табл.).
СВОЙСТВА АЛЬДЕГИДОВ
|
Соединение
|
Название
|
Т. пл., С
|
Т. кип., 0С
|
dl°
|
|
ИЮПАК тривиальное
|
|
СН20
|
Метана ль
|
Формальдегид, муравьиный А.
|
-92
|
-21
|
0.815
|
|
сн3сно
|
Этаналь
|
Ацетальдегид, уксусный А.
|
-123,5
|
20,16
|
0,778
|
|
С2Н5СНО
|
Пропаналь
|
Пропионовый А.
|
от -81 до -80
|
48^9
|
0.806
|
|
С3Н7СНО
|
Бутаналь
|
Бутиральдегид, масляный А.
|
-99
|
74-75
|
0,804
|
|
сн2=снсно
|
Пропеналь
|
Акролеин, акриловый А.
|
от -88 до -86.5
|
52,7
|
0,838
|
|
СН3СН=CHCHO
|
2-Бутеналь
|
Кротоновый А.
|
от -77 до -76
|
102
|
0,858 (150С)
|
|
С6Н5СНО
|
Бензальдегид
|
|
-26
|
179
|
1.050
|
В ИК-спектрах А. характеристич. полосы поглощения vС=о лежат
в области 1740-1720 см-1 (алифатич. А.), 1715-1695 см-1
(ароматич.), 1705-1685 см-1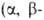 непредельные); VC_H -B области 2880-2650
см-1. Хим. сдвиг альдегидного протона в спектрах ЯМР (1Н)-в
области 9,4-9,7 м.д. (алифатич. А.) и 9,6-10,1 м.д. (ароматич.). Характерный
дублет в спектрах ЯМР (13С), обусловленный группой 13СНО
- в области 190-205 м.д. (на 5-10 м.д. в более сильном поле, чем сдвиги
13СО
соответствующих кетонов). Электронные спектры содержат полосы с
непредельные); VC_H -B области 2880-2650
см-1. Хим. сдвиг альдегидного протона в спектрах ЯМР (1Н)-в
области 9,4-9,7 м.д. (алифатич. А.) и 9,6-10,1 м.д. (ароматич.). Характерный
дублет в спектрах ЯМР (13С), обусловленный группой 13СНО
- в области 190-205 м.д. (на 5-10 м.д. в более сильном поле, чем сдвиги
13СО
соответствующих кетонов). Электронные спектры содержат полосы с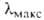 290 нм для RCHO (R = CH3, C2H5, С3Н7),
345 нм для акролеина и 327 нм для кретонового А. (во всех случаях
290 нм для RCHO (R = CH3, C2H5, С3Н7),
345 нм для акролеина и 327 нм для кретонового А. (во всех случаях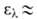 15-25);
масс-спектры (RCHO)-пики, отвечающие ионам (НСО) + , (RCO) +
и R + . Если А. имеют атомы Н в 15-25);
масс-спектры (RCHO)-пики, отвечающие ионам (НСО) + , (RCO) +
и R + . Если А. имеют атомы Н в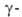 положении,
то для линейных соед. характерны пики при т/е 44, а для положении,
то для линейных соед. характерны пики при т/е 44, а для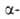 разветвленных
- при т/е 44 + 12и, где п — 1, 2, 3... разветвленных
- при т/е 44 + 12и, где п — 1, 2, 3...
А. - один из наиб. реакционноспособных классов орг. соединений. Низшие
А. легко полимеризуются. По степени окисленности А. занимают промежут.
положение между спиртами и карбоновыми к-тами, чем во многом определяются
их св-ва. А. легко окисляются О2 воздуха до к-т уже при хранении
(промежут. продукт - пероксикислота):
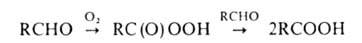
Восстанавливаются под действием Н2 (кат.-Pt или Ni), а также
донорами гидрид-ионов, напр. LiAlH4 и NaBH4, в первичные
спирты. При восстановлении ароматич. А. металлами или электрохимически
получаются лиарилзамещенные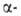 гликоли.
Диспропорционируют с образованием спирта и к-ты: 2С6Н5СНО
+ Н2О -> С6Н5СН2ОН + С6Н5СООН
(р-ция Канниццаро) или сложного эфира: 2RCHO -> RCOOCH2R (р-ция
Тищенко). Восстанавливаются спиртами в присут. алкоголята А1 (р-ция Меервейна-Понндорфа-Верлея):
RCHO + (СН3)2СНОН гликоли.
Диспропорционируют с образованием спирта и к-ты: 2С6Н5СНО
+ Н2О -> С6Н5СН2ОН + С6Н5СООН
(р-ция Канниццаро) или сложного эфира: 2RCHO -> RCOOCH2R (р-ция
Тищенко). Восстанавливаются спиртами в присут. алкоголята А1 (р-ция Меервейна-Понндорфа-Верлея):
RCHO + (СН3)2СНОН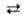 RCH2OH
+ (СH3)2 = О. Ароматич. А. вступают в бензоиновую
конденсацию. RCH2OH
+ (СH3)2 = О. Ароматич. А. вступают в бензоиновую
конденсацию.
Вследствие поляризации связи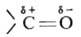 А. способны присоединять по карбонильной группе нуклеофилы: воду, спирты,
амины и др. Обычно А. значит. активнее в р-циях с нуклеофилами, чем кетоны.
наиб. легко реагирует формальдегид, к-рый в водном р-ре находится преим.
в гидра-тированной форме. В спиртовом р-ре А. образуют последовательно
полуацетали и ацетали: RCHO + R'OH -> RCH(OR')OH
А. способны присоединять по карбонильной группе нуклеофилы: воду, спирты,
амины и др. Обычно А. значит. активнее в р-циях с нуклеофилами, чем кетоны.
наиб. легко реагирует формальдегид, к-рый в водном р-ре находится преим.
в гидра-тированной форме. В спиртовом р-ре А. образуют последовательно
полуацетали и ацетали: RCHO + R'OH -> RCH(OR')OH RCH(OR')2, при взаимод. с гидро-ксиламином-оксимы RCH=NOH, с
гидразином-гидра-зоны RCH=NNH2 и азины, с первичными аминами-основания
Шиффа (азометины) RCH=NR'; со вторичными аминами A. RCH2CHO
дают енамины RCH=CHNR2. Из СН2О и NH3
в пром-сти получают гексаметилентетрамин (уротропин). Образование ацеталей
и енаминов используется в синтезе как метод защиты альдегидной группы;
р-ция А. с NaHSO3, приводящая к кристаллич. аддуктам, - для
выделения и очистки А.
RCH(OR')2, при взаимод. с гидро-ксиламином-оксимы RCH=NOH, с
гидразином-гидра-зоны RCH=NNH2 и азины, с первичными аминами-основания
Шиффа (азометины) RCH=NR'; со вторичными аминами A. RCH2CHO
дают енамины RCH=CHNR2. Из СН2О и NH3
в пром-сти получают гексаметилентетрамин (уротропин). Образование ацеталей
и енаминов используется в синтезе как метод защиты альдегидной группы;
р-ция А. с NaHSO3, приводящая к кристаллич. аддуктам, - для
выделения и очистки А.
Исключительно важна в орг. синтезе альдольная конденсация с образованием
гидроксиальдегидов. Последние легко отщепляют воду, превращаясь в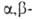 непредельные
альдегиды (кретоновая конденсация): непредельные
альдегиды (кретоновая конденсация):
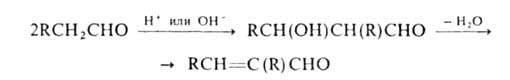
В сходных р-циях ароматич. А. с ангидридами карбоновых к-т (р-ция Перкина),
а также алифатич. и ароматич. А. с эфирами малоновой к-ты (р-ция Кнёвенагеля)
образуются соответственно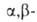 непредельные
кислоты или их эфиры, например: непредельные
кислоты или их эфиры, например:
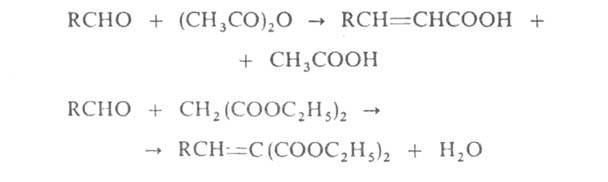
Конденсация А. с эфирами янтарной к-ты приводит к алкилиденянтарным
к-там (р-ция Штоббе), с аминокислотами - к азлактонам (р-ция Эрленмейера
- Плёхля). Нуклеоф. присоединение по карбонильной группе А. лежит в основе
синтеза: спиртов - взаимод. А. с реактивами Гриньяра или другими металлоорг.
соед., а также с ацетиленом (р-ция Реппе): 2СН2О + НС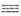 СН
-> НОСН2С СН
-> НОСН2С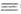 ССН2ОН; ССН2ОН;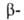 аминокарбонильных соед.-взаимод. А. или кетонов с СН2О и аминами
(р-ция Манниха): СН3СОСН3 + СН2О + (С2Н5)2МН
* НС1 -> СН3СОСН2СН2М(С2Н5)2
* НС1 + Н2О; олефинов - конденсацией А. с алкилиденфосфоранами
(р-ция Виттига): RCH2O + (С6Н5)3
аминокарбонильных соед.-взаимод. А. или кетонов с СН2О и аминами
(р-ция Манниха): СН3СОСН3 + СН2О + (С2Н5)2МН
* НС1 -> СН3СОСН2СН2М(С2Н5)2
* НС1 + Н2О; олефинов - конденсацией А. с алкилиденфосфоранами
(р-ция Виттига): RCH2O + (С6Н5)3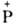 -СН2
-> RCH=CH2 + (С6Н5)3РО; глицидных
эфиров - р-цией А. с эфирами -СН2
-> RCH=CH2 + (С6Н5)3РО; глицидных
эфиров - р-цией А. с эфирами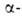 галогенкарбоновых
к-т (р-ция Дарзана): галогенкарбоновых
к-т (р-ция Дарзана):
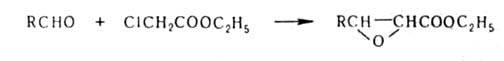
Карбонильная группа А. способна участвовать также в р-циях Анри, Кижнера
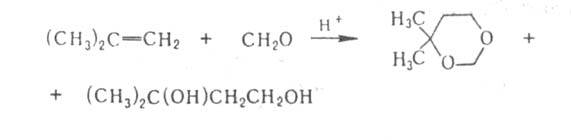
- Вольфа, Лейкарта, Штреккера и др. А. (гл. обр. СН2О) реагируют
как электроф. реагенты с олефинами, образуя 1,3-диоксаны и 1,3-гликоли
(р-ция Принса), напр.:
Электроф. замещение в ароматич. ядре под действием А. приводит к арилкарбинолам.
Р-ция СН2О с фенолами лежит в основе произ-ва феноло-формальд.
смол.
А., содержащие ос-атом Н, легко образуют енолы и еноляты, к-рые реагируют
как нуклеофилы при галогенировании их Вr2, N-бромсукцинимидом,
SO2C12, при тиилировании дисульфидами, алкилировании
и ацилировании алкили ацилгалогенидами.
При гомолитич. присоединении А. к олефинам, инициируемом пероксидами
или О2, образуются кетоны, при фотохим. р-ции А. с олефинами
- оксациклобутаны (оксетаны), напр.:
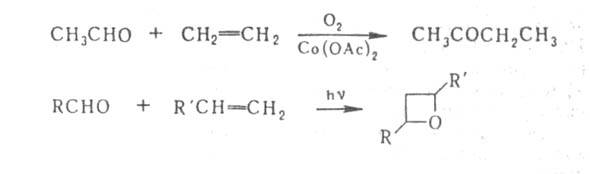
А. декарбонилируются (кат.-Rh) с образованием углеводородов.
К А. относятся важнейшие моно- и олигосахариды - глюкоза, лактоза и
др. Содержатся А. в эфирных маслах, напр. цитраль - в лемонграссовом (до
80%) и кориандровом маслах, цитронеллаль - в цитронелловом ( ~ 30%) и эвкалиптовом,
бензальдегид - в масле горького миндаля; плоды ванили содержат 1,5-3% ванилина.
Дегидрирование спиртов над Ag, Си или монохромовыми катализаторами -
наиб. общий пром. метод произ-ва А. (в осн. формальдегида и А. состава
С5 и выше). Ацетальдегид производят гл. обр. окислением этилена,
а также каталитич. гидратацией ацетилена (р-ция Кучерова), акролеинокислением
пропилена, пропионовый и масляный А. - гидроформилированием соотв. этилена
и пропилена. А. синтезируют в пром-сти также каталитич. восстановлением
карбоновых к-т (гл. обр. высших) муравьиной к-той, гидролизом дигалогенозамещенных
углеводородов.
Препаративные методы получения А.: окисление спиртов хроматами или кетонами
в присут. алкоголятов А1 (р-ция Оппенауэра); озонолиз олефинов; восстановление
разл. производных карбоновых к-т, напр. хлорангидридов-Н2 в
присут. Pd (р-ция Розенмунда), нитрилов-гидридами металлов с послед. гидролизом
образующихся альдиминов и т.п.; взаимод. реактивов Гриньяра с ортомуравьиным
эфиром; перегруппировка аллилвиниловых эфиров (перегруппировка Клайзена);
окисление 1,2-гликолей йодной к-той или (СН3СОО)4Рb,
а также р-ции Даффа, Нефа, Раймера-Тимана, Соммле, синтезы Гаттермана и
Гаттермана- Коха.
Для качеств. определения А. обычно применяют р-р AgNO3 в
избытке водного р-ра NH3 (образование серебряного зеркала) или
реактив Фелинга-щелочной р-р, содержащий CuSO4 и соль винной
к-ты (выделение красного осадка Си2О). Эти реагенты не взаимодействуют
с кетонами.
А. применяют для получения спиртов (бутиловых, 2-этилгексанола, пентаэритрита
и др.), карбоновых к-т и их производных (напр., уксусной, надуксусной,
уксусного ангидрида, винилацетата, ацетопропилацетата),
полимеров, антиоксидантов, пиридиновых оснований и др. А., содержащие 8-12
атомов С,-душистые в-ва. наиб. объем мирового произ-ва А. (неск. млн. т/год)
приходится на альдегиды С1-С4. ацетопропилацетата),
полимеров, антиоксидантов, пиридиновых оснований и др. А., содержащие 8-12
атомов С,-душистые в-ва. наиб. объем мирового произ-ва А. (неск. млн. т/год)
приходится на альдегиды С1-С4.
А. раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно
влияют на нервную систему. С увеличением числа атомов углерода в молекуле
раздражающее действие ослабевает. Ненасыщенные А. обладают более сильным
раздражающим действием, чем насыщенные.
См. также Акролеин, Анисовый альдегид, Ацетальдегид, Бензальдегид,
Коричный альдегид. Масляный альдегид, Пропионовый альдегид, Салициловый
альдегид, Формальдегид и др.
===
Исп. литература для статьи «АЛЬДЕГИДЫ»: Робертс Д.Д., КасериоМ.К., Основы органической химии, пер.
с англ., т. 2, М., 1978; Бюлер К., Пирсон Д., Органические синтезы, пер.
с англ., ч. 2, М., 1973, с. 51-91; Бреттль Р., в кн.: Общая органическая
химия, пер. с англ., т. 2, М., 1982, с. 488-569; Kirk-Othmer encyclopedia.
3 ed, v. I, N. Y.-[a.o.], 1978, p. 790-98. М.Г.Виноградов.
Страница «АЛЬДЕГИДЫ» подготовлена по материалам химической энциклопедии.
|

