|
ГЕМОГЛОБИН (от греч. haima- кровь и лат. globus-шар), осн. белок
дыхат. цикла, участвующий в переносе О2 от органов дыхания к
тканям, а в обратном направлении - СО2. Содержится в эритроцитах
крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных.
Г. позвоночных (мол. м. 6,4*104-6,6*104) состоят
из четырех попарно идентичных субъединиц (их обозначают греч. буквами;
теми же буквами обозначают входящие в состав субъединиц полипептидные цепи,
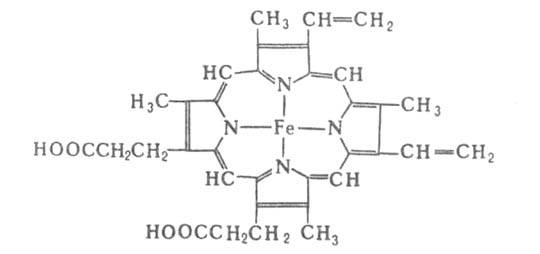
а также гены, кодирующие эти цепи). Каждая субъединица имеет белковую глобиновую
часть, состоящую из 140-160 аминокислотных остатков, с к-рой нековалентно
связан гем-ферропрото-порфирин (см. ф-лу).
Ф-цию переноса О2 у нек-рых видов беспозвоночных выполняют
крупные гемсодержащие белки-эритрокруорины (мол. м. 0,4*106-6,7*106),
состоящие из 30-400 субъединиц, и хлоркруорины (мол. м. 3,4*106),
состоящие из 190 субъединиц. Эти белки способны обратимо связывать одну
молекулу О2 на группу тема, т.е. на субъединицу. Переносчиком
О2 у др. видов беспозвоночных служат негемовые белки, состоящие
из 8-10 субъединиц,— медьсодержащие гемоцианины (мол. м. 0,05*107*107)
и железосодержащие гемэритрины (мол. м. 1*105). Каждая субъединица
таких белков содержит два атома металла (соотв. Сu + и Fe2
+), способных связать одну молекулу О2.
Г. взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит
к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с
осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из
двух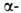 и двух и двух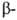 субъединиц,
их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков.
Известны первичная структура обеих цепей, а также пространств. структура
оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной
формы (содержит Fe3 +) НbА. Пространств. структура
субъединиц (рис. 1) характеризуется наличием восьми субъединиц,
их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков.
Известны первичная структура обеих цепей, а также пространств. структура
оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной
формы (содержит Fe3 +) НbА. Пространств. структура
субъединиц (рис. 1) характеризуется наличием восьми спиральных
участков, включающих около 80% аминокислотных остатков, и внутр. полости
-гемового кармана. Фиксирование тема в субъединице осуществляется в результате
гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич.
боковыми радикалами аминокислот, выстилающими полость кармана, а также
благодаря координационной связи (направлена перпендикулярно к плоскости
кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой
гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2
занимает шестое вакантное место в координационной сфере Fe2+.
Связывание происходит обратимо, без окисления железа, с образованием стабильного
оксигенированного комплекса НbО2. Одна молекула Г. способна
присоединить 4 молекулы О2-по одной на группу тема. спиральных
участков, включающих около 80% аминокислотных остатков, и внутр. полости
-гемового кармана. Фиксирование тема в субъединице осуществляется в результате
гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич.
боковыми радикалами аминокислот, выстилающими полость кармана, а также
благодаря координационной связи (направлена перпендикулярно к плоскости
кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой
гистидина (т. наз. проксимальный гистидин). При оксигенации молекула О2
занимает шестое вакантное место в координационной сфере Fe2+.
Связывание происходит обратимо, без окисления железа, с образованием стабильного
оксигенированного комплекса НbО2. Одна молекула Г. способна
присоединить 4 молекулы О2-по одной на группу тема.
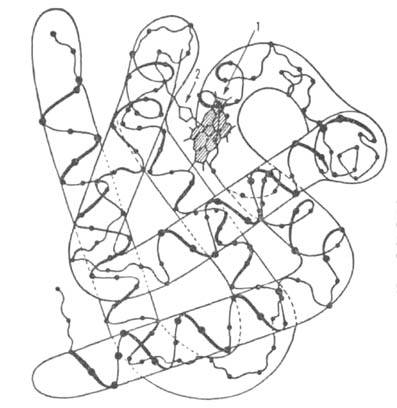
Рис. 1. Схема упаковки поли-пептидной цепи субъединицы
гемоглобина. Точками обозначены положения субъединицы
гемоглобина. Точками обозначены положения С
атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина. С
атомов аминокислотных остатков; 1 -гем; 2-проксимальный остаток гистидина.
Субъединицы и
и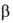 прочно
удерживаются в составе тетрамера Г. множественными ван-дер-ваальсовыми
взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована
кроме того неск. ионными связями внутри и между субъединицами. Теграмер
Г.-кооперативная структура, в к-рой существует взаимод. пространственно
разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется
в облегчении присоединения к тетрамеру последующих молекул О2
по мере протекания оксигенирования, что значительно увеличивает эффективность
переноса О2 при физиол. условиях по сравнению с мономерными
Г. и миоглобином (белок, депонирующий О2 в мышцах). Присоединение
О2 к молекуле Г. сопровождается значит. конформационными перестройками
пространств. структуры субъединиц и тетрамера в целом. прочно
удерживаются в составе тетрамера Г. множественными ван-дер-ваальсовыми
взаимод. и водородными связями; дезоксигенированная форма НbА стабилизирована
кроме того неск. ионными связями внутри и между субъединицами. Теграмер
Г.-кооперативная структура, в к-рой существует взаимод. пространственно
разобщенных между собой групп (т. наз. гем-гем взаимодействие). Это проявляется
в облегчении присоединения к тетрамеру последующих молекул О2
по мере протекания оксигенирования, что значительно увеличивает эффективность
переноса О2 при физиол. условиях по сравнению с мономерными
Г. и миоглобином (белок, депонирующий О2 в мышцах). Присоединение
О2 к молекуле Г. сопровождается значит. конформационными перестройками
пространств. структуры субъединиц и тетрамера в целом.
Сродство Г. к О2 является основным физ.-хим. показателем
функциональных св-в Г.; его принято характеризовать зависимостью степени
оксигенирования Г. от парциального давления кислорода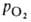 (кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной
(кислородно-диссоционная кривая, или КДК, рис. 2), а также величиной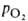 ,
при к-рой достигается оксигенирование 50% Г. (р50)- Нормальная
величина р50 НbА в крови при физиол. условиях [37 °С, парциальное
давление СО2 ,
при к-рой достигается оксигенирование 50% Г. (р50)- Нормальная
величина р50 НbА в крови при физиол. условиях [37 °С, парциальное
давление СО2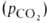 40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер
КДК отражает кооперативный характер оксигенирования. При существующем у
человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±
40 мм рт. ст., рН 7,4] составляет 26-28 мм рт. ст. Сигмоидный характер
КДК отражает кооперативный характер оксигенирования. При существующем у
человека различии артериальной и венозной крови (соотв. 90 ± 10 и 40 ±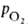 2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% Г. находится
в форме НbО2), отдает в тканях ок. 45 мл О2, при
этом содержание НbО2 в венозной крови составляет 70-75%.
2 мм рт. ст.) 1 л крови, насыщенной в легких кислородом (92-98% Г. находится
в форме НbО2), отдает в тканях ок. 45 мл О2, при
этом содержание НbО2 в венозной крови составляет 70-75%.
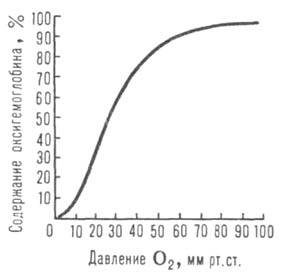
Рис. 2. Зависимость содержания оксигемоглобина от парциального давления
О2.
Из клеток тканей СО2 диффундирует через плазму крови в эритроциты,
где гидратируется в р-ции, катализируемой ферментом карбоангидразой:
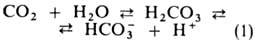
Гидрокарбонат-ионы в эритроцитах замещаются далее на ионы Cl-
из плазмы, сами переходят в плазму и переносятся ею к легким. Определенная
часть СО2 связывается в эритроцитах с N-концевыми аминогруппами
Г. с образованием остатка карбаминовой к-ты, уменьшая сродство Г. к О2.
Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают
сродство Г. к О2. Важнейший внутриэритроцитарный регулятор сродства
- анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также
уменьшает сродство Г. к О2. Снижение сродства при уменьшении
рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием
равновесия: аминогруппами
Г. с образованием остатка карбаминовой к-ты, уменьшая сродство Г. к О2.
Увеличение РСО2 т-ры, ионной силы р-ра и уменьшение рН снижают
сродство Г. к О2. Важнейший внутриэритроцитарный регулятор сродства
- анионы 2,3-дифосфоглицериновой к-ты. Увеличение их концентрации также
уменьшает сродство Г. к О2. Снижение сродства при уменьшении
рН в интервале 9-6 наз. щелочным эффектом Бора, к-рый обусловлен существованием
равновесия:
Этот эффект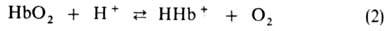 вносит значит. вклад в поддержание постоянного значения рН крови и освобождение
О2 в тканях соотв. уровню обмена в-в [увеличение концентрации
СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где
рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями
(1) и (2), идут в обратном направлении, в результате чего СО2,
находящийся в растворенном и связанном с Г. состоянии, освобождается, Г.
оксигенируется и дыхат. цикл завершается.
вносит значит. вклад в поддержание постоянного значения рН крови и освобождение
О2 в тканях соотв. уровню обмена в-в [увеличение концентрации
СО2 сдвигает равновесие р-ций (1) и (2) вправо]. В легких, где
рСО2 составляет 40 мм рт. ст., процессы, описываемые р-циями
(1) и (2), идут в обратном направлении, в результате чего СО2,
находящийся в растворенном и связанном с Г. состоянии, освобождается, Г.
оксигенируется и дыхат. цикл завершается.
У человека на разных этапах развития организма обнаружено несколько
Г., различающихся составляющими их субъединицами. На ранних стадиях эмбрионального
развития у зародыша обнаруживаются Г. строения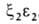 , ,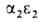 , ,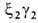 . На более поздних стадиях появляется и доминирует к моменту рождения HbF
(
. На более поздних стадиях появляется и доминирует к моменту рождения HbF
(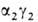 ; т. наз.
фетальный Г.). Св-ва эмбриональных Г. обеспечивают выполнение кисло-родтранспортной
ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого
человека содержится в норме 95-97% НЬА ; т. наз.
фетальный Г.). Св-ва эмбриональных Г. обеспечивают выполнение кисло-родтранспортной
ф-ции в специфич. условиях внутриутробной жизни. В эритроцитах взрослого
человека содержится в норме 95-97% НЬА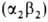 , начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2
, начинающего преобладать через 2-3 месяца после рождения, и 2-3% НbА2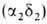
Первичные структуры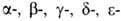 и
и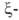 полипептидных
цепей Г. человека, а также мн. др. глобиновых цепей разл. происхождения
известны. Гены, кодирующие полипептидных
цепей Г. человека, а также мн. др. глобиновых цепей разл. происхождения
известны. Гены, кодирующие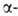 глобиновые
цепи Г. человека, сцеплены и расположены в последовательности глобиновые
цепи Г. человека, сцеплены и расположены в последовательности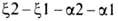 на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих
др. полипептидные цепи, также непосредственно примыкающие один к другому
на хромосоме 16 (цифры-номера дуплицированных генов); группа генов, кодирующих
др. полипептидные цепи, также непосредственно примыкающие один к другому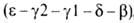 ,
локализована на хромосоме 11. Первичная структура ,
локализована на хромосоме 11. Первичная структура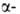 и
не и
не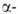 глобиновых
генов человека известна. Для каждого из них установлено наличие двух нитронов
(отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих
участков, находящихся на флангах генов. Биосинтез тема, глобиновых
генов человека известна. Для каждого из них установлено наличие двух нитронов
(отрезков ДНК, прерывающих кодирующие участки,-экзоны) и больших некодирующих
участков, находящихся на флангах генов. Биосинтез тема,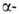 и
и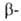 глобиновых
цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках
эритроцитарного ряда и практически завершается к моменту выхода зрелых
эритроцитов (их продолжительность жизни у человека составляет 120-130 дней)
из костного мозга в кровяное русло. глобиновых
цепей, а также сборка тетрамерных молекул НbА осуществляется в клетках
эритроцитарного ряда и практически завершается к моменту выхода зрелых
эритроцитов (их продолжительность жизни у человека составляет 120-130 дней)
из костного мозга в кровяное русло.
Точковые мутации в экзонах глобиновых генов могут вести к появлению
мутантных Г. с единичной аминокислотной заменой. Это м. б. причиной молекулярных
болезней — наследств. гемоглобинопатий. наиб. известный пример мутантного
Г.- HbS, в к-ром шестой от N-конца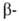 глобиновой
цепи остаток глутаминовой к-ты заменен на остаток валина. Такой Г. содержится
в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция
(выпадение участка ДНК) или другой дефект глобинового гена, локализованный
вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах,
нарушить сбалансированный биосинтез глобиновой
цепи остаток глутаминовой к-ты заменен на остаток валина. Такой Г. содержится
в эритроцитах больных серповидноклеточной анемией. Точечная мутация, делеция
(выпадение участка ДНК) или другой дефект глобинового гена, локализованный
вне экзонов, может уменьшить продукцию глобиновых цепей в эритроцитах,
нарушить сбалансированный биосинтез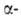 и и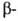 цепей
и привести к др. распространенной разновидности гемоглобинопатий-талассемии. цепей
и привести к др. распространенной разновидности гемоглобинопатий-талассемии.
===
Исп. литература для статьи «ГЕМОГЛОБИН»: Уайт А., Хендлер Ф., Смит Э., Основы биохимии, пер. с англ.,
т. 3, М, 1981, с. 1218-66; Bunn Н. F., Forget В. G., Ranney Н. М, Нетоglobinopathies,
Phil.- L.- Toronto, 1977; Human hemoglobins and hemoglobinopathies, "Texas
Reports on Biology and Medicine", 1980-1981, v. 40; Atlas of molecular
structures in bioldgy, ed. by D.C. Philips, P.M. Richards, v. 2, Haemoglobin
and myoglobin, ed. by G. Fermi and M.F. Perutz, Oxf., 1981; Methods in
enzymology, v. 76-Hemoglobins, N. Y.- L.- [a. o.], 1981. B.A. Спивак.
Страница «ГЕМОГЛОБИН» подготовлена по материалам химической энциклопедии.
|

