ИОНЫ СКУЛАЧЕВА
С 2005 г. в России в стенах Московского государственного университета им. М.В. Ломоносова проводится междисциплинарный инновационный проект, который может не только составить достойную конкуренцию зарубежным геронтологам, но и имеет реальные шансы на создание первого действенного геропротектора – лекарства против старости. Научный руководитель проекта — академик РАН В.П. Скулачев.Инвестором выступила Русско-азиатская инвестиционная компания (РАИнКо).

Для осуществления этого проекта инвестор и руководство МГУ в лице ректора В.А. Садовничего и деканов биомедицинских факультетов приняли решение пойти по пути, достаточно распространенному на Западе, но все еще необычному для России — создать «приуниверситетскую» биотехнологическую компанию. Так была создана «Митотехнология», уже три года ведущая проект «Практическое использование ионов Скулачева».
Это один из немногих случаев, когда научные разработки могут быть внедрены в практик. «Роснано» намерена вложить 710 миллионов рублей в производство инновационных лекарственных препаратов против возрастных заболеваний на основе «ионов Скулачева». Общий же бюджет проекта, уже одобренного наблюдательным советом «Роснано», составит до 1,8 миллиарда рублей.
«Финансирование будет проходить в несколько этапов, в зависимости от результатов клинических испытаний, которые были начаты в конце 2009 года. Вывод на рынок офтальмологических препаратов запланирован на 2013 год, препаратов системного действия – на 2016 год. Ожидаемые доходы проекта к 2016 году могут составить до 8,439 миллиарда рублей за счет организации производства в России и лицензирования технологии иностранным производителям», – говорится в сообщении.
В России проектная компания планирует организовать производство лекарственной субстанции, из которой на контрактной основе будут изготавливаться готовые лекарственные формы. Выход на международный рынок планируется осуществить через лицензирование технологии производства зарубежным компаниям.
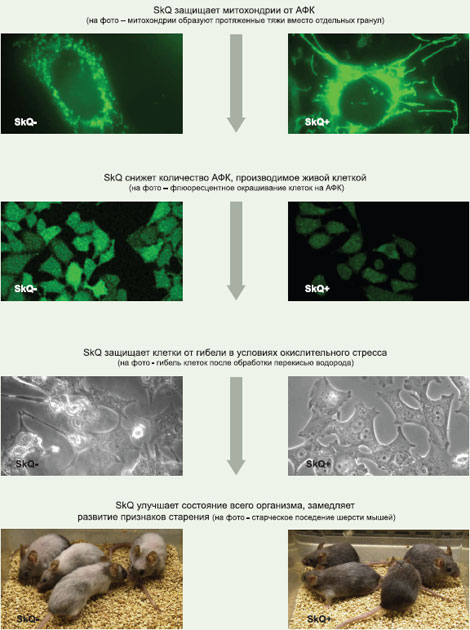
«Разработанные препараты уменьшают возрастные изменения в тканях на всех стадиях старения. Доклинические исследования демонстрируют существенное снижение смертности животных в среднем возрасте и за счет этого – увеличение средней продолжительности жизни. Максимальная продолжительность жизни увеличивается незначительно, однако животные остаются активными почти до самой смерти, не проявляя типичных признаков старения. Это свойство митохондриальных антиоксидантов дает возможность создать на их основе препараты от ряда опаснейших возрастных заболеваний. Они помогают бороться именно с возрастными изменениями, а не со смертностью в очень старом возрасте», – приводит пресс-служба слова научного руководителя проекта, академика РАН, директора НИИ физико-химической биологии им. Белозерского МГУ Владимира Скулачева.
Причины болезни
Борьба со старением — задача масштабная и не под силу какой-то одной научной группе. По сложности она сопоставима с проектом С.П. Королева по запуску первого спутника или «всемирным проектом» по расшифровке генома человека. Над решением этой задачи в мире бьются сотни лабораторий, включая Национальный институт старения США. К настоящему моменту существует более 300 научных теорий старения.
Существует множество теорий старения. Наиболее распространенной и убедительной из них считается свободно-радикальная гипотеза Д. Хармана, предположившего, что ведущую роль в ослаблении жизненных функций с возрастом играет окисление биополимеров активными формами кислорода (АФК). В соответствии с этой гипотезой было установлено, что при старении возрастает уровень окисленности ДНК, белков и липидов. Подобная ситуация может быть следствием увеличения в старости продукции АФК или ослаблении антиооксидантной защиты, либо просто длительности повреждающего воздействия АФК, пропорционального возрасту организма.
Одним из крупнейших открытий последних десятилетий стало обнаружение «программ смерти». Было установлено, что гибель клетки происходит, как правило, в результате выполнения одной из таких программ (апоптоза или некроза, а также их комбинации), заложенных в ее геноме.
Гипотеза Д. Хармана вместе с этим открытием послужила основанием для заключения, что, по крайней мере, одноклеточные организмы располагают механизмом самоликвидации. Было показано, что аналогичные «программы смерти» существуют у бактерий и одноклеточных эукариот, таких как, например, дрожжи. Существует множество примеров, доказывающих, что запрограммированная смерть особи процесс, названный «феноптозом» (процесс был так назван академиком В.П. Скулачевым, слово придумано и введено в обиход академиком, лингвистом М.Л. Гаспаровым. — Прим. ред), присущ также и высшим организмам — животным и растениям, хотя его молекулярные механизмы еще только предстоит выяснить. Биологический смысл феноптоза достаточно очевиден по аналогии с апоптозом — очищение популяции от нежелательных особей с целью защиты всей популяции, в случае если они несут для нее угрозу. Другой функцией феноптоза могло бы быть ускорение смены поколений.
Концепция феноптоза заставляет по-другому взглянуть на проблему старения. Что, если это тот способ, которым природа заставляет нас уходить, освобождая место молодым? Что, если это медленное угасание, также как и программа апоптоза, заложено в виде генетической программы в нашем геноме, и его основным биологическим смыслом является ускорение эволюции? Эти вопросы позволили нам сформулировать теорию запрограммированного старения как инструмента эволюции.
Чем глубже биологи проникают в механизм функционирования живых систем, тем больше они убеждаются, что природа старается держать под строжайшим контролем все процессы, идущие в организме, особенно связанные с его развитием, с наследственностью. В этой связи представляется особенно невероятным, что природа отдала такой важнейший этап, как старение и смерть организма, на откуп случайным обстоятельствам и не запрограммировала в геноме управление этим процессом.
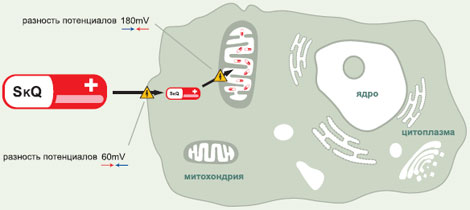
МЕХАНИЗМ ДЕЙСТВИЯ МИТОХОНДРИАЛЬНО-АДРЕСОВАННЫХ АНТИОКСИДАНТОВ
Подход к лечению болезни
Теория старения как медленного феноптоза дает нам шанс. Если существует программа, медленно, но верно ведущая нас к смерти, то, возможно, в нее можно вмешаться, перенастроить ее, замедлить, сломать. К сожалению, на данном этапе развития биоинженерия еще не вполне созрела для создания новых биологических систем, биохимических путей и т.п. Но ломать всегда проще, чем строить. Сейчас наука располагает мощнейшим арсеналом средств, позволяющих останавливать реализацию самых разных генетических программ. Почему бы не добавить в их список и программу старения?
Речь не идет об изменении генома — сегодня человек еще не готов к вмешательству в собственные гены. Биология не в силах предсказать все последствия такого шага, т.к. он может быть необратим для организма. Остается фармакологический подход — разработка вещества, способного не столько изменить саму программу старения, сколько помешать ее реализации, действуя на определенную мишень — какой-то элемент, процесс в клетке или организме, принципиально важный для работы вредоносной программы. Где искать эту мишень?
Здесь необходимо вернуться к гипотезе Д. Хармана. Безусловно, активные формы кислорода (АФК) — подходящие кандидаты на роль «самурайского меча», используемого организмом, решившим совершить биохимическое самоубийство. Даже если они и не являются прямой причиной старения, то, безусловно, принимают непосредственное участие в этом процессе. В клетке существует множество различных АФК, которые выполняют самые разные (и не всегда вредные) функции. Где же искать те, что участвуют в процессах старения? В клетке существует целый набор ферментов, превращающих О2 в первичную форму АФК — супер-оксид (О2*-) или в его производное — перекись водорода. Однако все они по мощности значительно уступают дыхательной цепи внутренней мембраны митохондрий. За день митохондрии взрослого человека поглощают около 400 л О2, превращая его в воду путем четырехэлектронного восстановления. Однако, если хотя бы 0,1% этого количества О2 будет восстановлено химически более простым, одноэлектронным образом, то получится 0,4 л О2*-, что намного превышает возможности всех прочих механизмов генерации АФК, вместе взятых. Фактически мы носим в своих митохондриях потенциальный генератор сильнейшего яда, который легко может убить наши клетки и нас самих вместе с ними. Такая катастрофа произойдет даже не из-за прямого токсического действия АФК, а вследствие запуска процессов апоптоза или некроза, мощными индукторами которых служат АФК.
Следовательно, митохондриальные АФК являются привлекательным кандидатом на роль «мишени», поразив которую, можно было бы «уничтожить» биохимический механизм самоубийства.
СТРАТЕГИЯ ИССЛЕДОВАНИЙ
Поиск инструмента
Фармакологический способ борьбы с АФК давно известен — это антиоксиданты. По поводу лечения ими старения существует весьма обширная и неоднозначная литература — от заявления американского биохимика Б. Эймса и его коллег, что такое лекарство от старости уже найдено, до выводов Д. Хоуэса о полной бесплодности этого подхода и, стало быть, ошибочности свободно-радикальной гипотезы Д. Хармана. Но, по нашему мнению, в работах по лечению старости антиоксидантами есть несколько существенных упущений. Во-первых, должны использоваться антиоксиданты, адресованные именно в митохондрии. Во-вторых, они должны быть безопасными, так как, взаимодействуя с АФК, молекулы антиоксиданта сами становятся радикалами; соответственно, в клетке должен существовать надежный способ немедленной их нейтрализации, желательно с восстановлением антиоксиданта в его изначальном виде. В третьих, все антиоксиданты обладают прооксидантным эффектом при повышении дозы, ограничивающим возможность их применения, т.е. они должны обладать высокой эффективностью в как можно более низких дозах. Наконец, традиционные антиоксиданты, даже если они могут оказаться в митохондриальной мембране наряду с другими мембранами клетки, представляют собой природные вещества, избыток которых может быть расщеплен клеточными ферментами, коль скоро их присутствие становится нежелательным. Фактически организм располагает системами защиты не только от кислорода, но и от антиоксидантов. А все дело в том, что АФК выполняет целый ряд биологических функций, без которых полноценная жизнь невозможна (они, например, непосредственно участвуют в борьбе с бактериями и вирусами).
Следовательно, антиоксидант должен убирать не АФК, а только их избыток, образующийся внутри митохондрий по мере старения организма; ему не следует инактивироваться ферментами организма, стремящегося во что бы то не стало завершить свой онтогенез включением программы старения.
К сожалению, ни один из известных к концу XX в. антиоксидантов не отвечает всем этим требованиям. Реальный кандидат появился только в начале этого века.
МЕТОД РАЗРАБОТКИ ПРЕПАРАТОВ

Ионы Скулачева
На рубеже 1960—1970-х гг. мы (группа ученых из МГУ им. М.В. Ломоносова совместно с группой доктора физико-математических наук Е.А. Либермана из Академии Наук СССР) обнаружили, что некоторые соединения — липофильные катионы (например, фосфония), способны адресно проникать в митохондрии живой клетки.
В 1974 г. такие соединения были названы американским биохимиком Д. Грином «ионами Скулачева».
В начале 70-х гг. нами (В.П. Скулачевым, доктором химических наук Л.С. Ягужинским, академиком С.Е. Севериным. — Прим. ред.) было высказано предположение, что проникающие катионы могут использоваться митохондрией как «молекулы-электровозы» для накопления в митохондриях незаряженных веществ, присоединенных к этим катионам.
В конце 1990-х гг. британский биохимик М.П. Мерфи использовал этот подход, попытавшись создать митоходриально-адресованный антиоксидант. Он присоединил к липофильному иону трифенилалкилфосфония витамин Е. К сожалению, это вещество, равно как и его несколько более удачный вариант, в котором вместо витамина Е использован убихинон, до сих пор не нашло применения на практике, видимо, из-за сильного прооксидантного действия и недостаточной эффективности в низких дозах. Перспективность всего подхода оказалась под сомнением.
Однако в 2003 г. мы начали разработку нового митоходриально-адресованного антиоксиданта. Чтобы принципиально повысить его эффективность, был использован пластохинон, вещество из самого насыщенного кислородом места в живой природе — хлоропластов растений. Было сконструировано и синтезировано вещество SkQ1, эффективность которого оказалась в сотни раз выше, чем у предыдущих аналогов.
ПАТЕНТОВАНИЕ
На данный момент компания «Митотехнология» подала более 10 заявок на международные патенты на разрабатываемые технологии и способы их применения в разных областях медицины и биотехнологии. Ключевым звеном в защите ИС компании является т.н. «зонтичный» патент, защищающий суть базовой технологии проекта — митохондриально-адресованные биологически-активные вещества, в частности — митохондриальные антиоксиданты типа SkQ. Патент на эту технологию уже получен в России, подана заявка на национальный патент США
Метод разработки технологий и препаратов
Поставив целью борьбу со старением, мы понимали, что такая задача не под силу одной научной группе. Как можно в современном мире быстро найти ресурсы (финансовые, интеллектуальные, людские) на осуществление подобного проекта? Логика подсказывала единственный ответ — если рассматривать старость как болезнь, то речь идет о создании нового лекарственного препарата. Для решения такой фундаментальной задачи на базе Московского государственного университета был организован междисциплинарный инновационный проект, объединивший команду ученых (биологов и медиков, химиков, физиков, математиков).
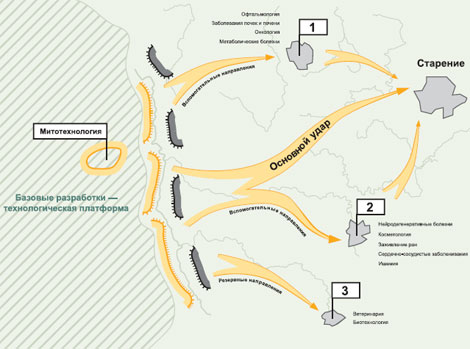
Основной технологический подход — это направленное воздействие на митохондрии клеток живого организма с целью регулирования количеств АФК, производимых этими митохондриями — своеобразная инженерия митохондрий, или «митоинженерия». Ее осуществление возможно, например, при помощи адресной доставки высокоэффективных антиоксидантов в митохондрии живой клетки. Технология, позволяющая осуществлять эту доставку, получила название «митотехнологии».
Поскольку митохондрии содержатся и продуцируют АФК практически во всех клетках организма, сфера применения митотехнологии крайне широка. Тот же подход может быть применен для борьбы с другими заболеваниями, для которых показана негативная роль АФК (особенно если известен вклад именно митохондриальных АФК). Следовательно, если митотехнология окажется действительно эффективной, то на ее базе возможна разработка целого семейства лекарственных препаратов, содержащих в качестве действующего начала различные (или одинаковые, но в разной дозировке и лекарственной форме) митохондриально-адресованные антиоксиданты. В этом состоит главная стратегия исследований. Наряду с максимально детальной разработкой технологической платформы (митотехнологии) по мере получения подтверждения ее работоспособности идет параллельная разработка нескольких лекарственных препаратов. Постадийно метод разработки препаратов приведен на рис. вверху.
Чем глубже биологи проникают в механизм функционирования живых систем, тем больше они убеждаются, что природа старается держать под строжайшим контролем все процессы, идущие в организме, особенно связанные с его развитием и наследственностью
Все начинается с создания структуры и синтеза нового соединения (группами химического синтеза). Будучи синтезированным, новое вещество передается другим группам на исследование свойств, сначала физико-химических и, если они отвечают требованиям (например, стабильность вещества, его гидрофобность, анти- и прооксидантные свойства в химических реакциях), то начинаются испытания на биологических системах in vitro.
На модельной системе (искусственных плоских липидных мембранах) оценивается проникающая способность соединений. На тех же мембранах, но со встроенными пептидными ионными каналами грамицидина можно показать защитное действие веществ на мембранные белки. Большое количество опытов ведется на изолированных митохондриях, что дает возможность измерять антиоксидантные свойства веществ, искать побочные эффекты. Наконец, проводятся исследования биологической активности веществ на разнообразных культурах клеток. В первую очередь изучается способность SkQ защищать клетки в стрессовых условиях, предотвращать некроз и апопотоз, индуцированные АФК.
Некоторые эксперименты с SkQ могут быть проведены на изолированных органах и тканях животных. Так, в рамках офтальмологического направления был выполнен большой объем работ по искусственному культивированию заднего сектора глаза, большое количество опытов по кардиологии проведено на модели изолированного перфузионного сердца. В случае удовлетворительных результатов in vitro и ex vivo, SkQ поступает в распоряжение научных групп, ведущих исследования на целых организмах. SkQ представляет собой новый класс биологически активных соединений. В связи с этим изучение их свойств должно включать в себя опыты на самых разных организмах — от одноклеточных до человека. Сегодня ведутся исследования, в частности, на бактериях, одноклеточных грибах (в том числе дрожжах), мицелиальных грибах, высших растениях, беспозвоночных — нематодах (Caenorhabditis elegans), коловратках, рачках, насекомых (дрозофилах), рыбах (Nothobranchius furzeri), грызунах — мышах и крысах различных линий, слепушонках, кроликах. Поскольку препараты проекта планируется применять и в ветеринарии, идут клинические испытания на собаках, кошках и лошадях — пациентах ветеринарных клиник. Такой широкий спектр исследований необходим для выяснения максимально большого числа аспектов биологического действия разрабатываемых веществ.
После получения первых результатов стало понятно, что различные варианты SkQ могут быть эффективны при лечении некоторых заболеваний, в том числе старческих. Такое заключение было сделано на основе анализа данных по действию вещества на различные организмы.
С этого момента стало возможным проведение прицельных исследований, направленных на разработку препаратов против конкретных болезней, что включает в себя стадию испытаний действия вещества на модельных животных.
Особняком стоит группа так называемых «опытов на дожитие» — экспериментов, в которых животные получали препарат в низких дозах в течение всей жизни. Здесь основным параметром, который интересовал исследователей, была продолжительность жизни подопытных животных. Первый такой опыт на мышах стартовал еще в конце 2004 г. и осенью 2007 г. был завершен. Результаты оказались крайне обнадеживающими — удалось существенно увеличить среднюю продолжительность жизни животных, замедлить развитие нескольких признаков старения, в том числе отсрочить появление старческих нарушений репродуктивной функции.
В случае успеха часть экспериментов, проводимых на животных, оформляется как официальные доклинические испытания. Разрабатываются и производятся опытные партии лекарственных форм, их эффективность и безопасность также исследуются в соответствующих учреждениях. Результаты готовятся к рассмотрению Министерством здравоохранения и социального развития РФ для получения разрешения на начало клинических исследований.
ИНФОРМАЦИОННАЯ СИСТЕМА
Количество ученых, участвующих в исследованиях, близится к 300. Из-за резкого увеличения потока данных, поступающих от групп, был предложен способ оптимизации сбора и анализа поступающей информации. Одной из рекомендаций было внедрение в рамках проекта единой компьютерной информационной системы управления. В 2006—2007 гг. система была разработана программистами. Начиная со второго квартала 2007 г. все ключевые организационные работы ведутся в информационной системе — АСУ «Мито»
Основные результаты
В 2005 г. была доказана действенность митотехнологии как способа борьбы с митохондриальными АФК, удалось получить первые подтверждения возможности реализации этого подхода на практике, хотя большая часть экспериментов велась in vitro. Положительная биологическая активность SkQ была продемонстрирована на нескольких системах.
В 2006 г. были организованы несколько новых лабораторий в МГУ и на современном оборудовании, начались масштабные эксперименты на животных, что сразу начало давать впечатляющие результаты. К исследованиям присоединились несколько западных исследовательских центров — компания Лонгевика, базирующаяся в медицинском институте Р.В. Джонсона в Нью-Джерси, Стокгольмский университет. К концу 2007 г. получены результаты, свидетельствующие о том, что SkQ способен задерживать развитие 14 признаков старения (например, старческие болезни глаз, старческое ослабление памяти, развитие сердечно-сосудистых заболеваний, старение репродуктивной системы, подверженность онкологическим заболеваниям и т.д.) в том числе и увеличивать продолжительность жизни самых разных животных (причем в зависимости от конкретного вида вещество может снижать раннюю смертность и увеличивать среднюю продолжительность жизни, продлевать максимальный возраст подопытных животных).
Эксперименты идут полным ходом. В них участвуют более 290 ученых в составе 40 групп, работающих более чем в 20 исследовательских центрах России, США и Швеции.
Исследования будут продолжаться и дальше с основной целью — разработка препарата, замедляющего старение. При этом будут идти работы и по созданию препаратов против конкретных старческих болезней. Так, по офтальмологическому направлению в нескольких ведущих глазных институтах России в 2008 г. начнутся клинические испытания глазных капель от увеита, некоторых ретинопатий, глаукомы. Проект начинает официальные доклинические исследования в США с целью получения разрешения FDA на проведение клинических испытаний. Наконец, некоторые изменения произойдут в организационной структуре — на базе проекта будет создан Учебно-научный центр митоинженерии МГУ.
Подробнее основные результаты будут изложены в отдельной статье, которая будет опубликована в одном из следующих номеров журнала.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
• Скулачев В.П. (2005) Вестник РАН, 75, 831—843.
• Скулачев В.П. (2007) Биохимия, 72, 1700—1714.
• 3. Atamna, H., Robinson, C., Ingersoll, R., Elliott, H., Ames, B.N. (2001) FASEB J., 15, 196-2204.
• Harman, D. (1956) J. Gerontol., 11, 298—300.
• 5. Howes, R.M. (2006) Ann. N.Y. Acad. Sci., 1067, 22—26.
• Liberman, E.A., Topali, V.P., Tsofina, L.M., Jasaitis, A.A., and Skulachev, V.P. (1969) Nature, 222, 1076—1078.
• Longo V.D., Mitteldorf J., Skulachev V.P., (2005), Nat. Rev. Genet., 6, 866—72.
ОБ АВТОРАХ
Владимир Петрович Скулачев - Научный руководитель проекта, один из основателей науки биоэнергетика. Академик РАН, член президиума Academia Europea, профессор МГУ, директор НИИ ФХБ им. А.Н. Белозерского МГУ, декан факультета биоинженерии и биоинформатики МГУ, лауреат Государственной премии СССР.
Максим Владимирович Скулачев — кандидат биологических наук, молекулярный биолог, ведущий научный сотрудник биологического факультета МГУ, заместитель руководителя проекта «Практическое использование ионов Скулачева».
Анна Тахмасибовна Королева — специалист по информационной поддержке проекта «Практическое использование ионов Скулачева».