МАГНИТНЫЕ НАНОЧАСТИЦЫ: создание (III часть)
Магнитные наночастицы для биомедицинских применений должны обладать необходимыми специальными параметрами. Как уже отмечалось выше, основным требованием, зачастую, является суперпарамагнетизм…

Основные необходимые элементы
Суперпарамагнетизм имеет место в магнитных материалах, состоящих из очень маленьких кристаллических блоков (пороговый размер зависит от природы материала, например, наночастица на основе железа становится суперпарамагнитной при размере <25 нм). В парамагнитном материале тепловая энергия преодолевает силы взаимодействия между соседними атомами при температуре, превышающей температуру Кюри, вызывая случайное блуждание в направлении намагничивания, в результате чего создается нулевой полный магнитный момент. Тем не менее, в суперпарамагнитных материалах блуждание влияет на направление намагничивания всего кристаллического блока. Магнитные моменты отдельных кристаллических блоков уравновешивают друг друга, и полный магнитный момент становится равным нулю. Реакция при воздействии внешнего магнитного поля сходна с реакцией парамагнитных частиц, однако в отличие от последних, в которых магнитное поле действует на каждый отдельный атом, магнитный момент кристаллических блоков принимает то же направление, что и поле (рис. 3.).
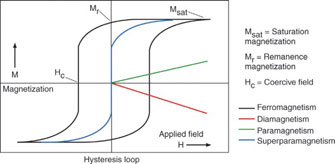
Рис. 3. Петли гистерезиса (зависимость намагниченности от внешнего магнитного поля), характерные для ферромагнитных и суперпарамагнитных наночастиц. Для сравнения также показаны кривые для диамагнитных и парамагнитных частиц. На рисунке также показаны значения остаточной намагниченности (Mr) и коэрцитивного поля (Hc).
M – намагниченность, H- приложенное поле, Msat – намагниченность насыщения, Mr – остаточная намагниченность.
В крупных наночастицах энергетические факторы способствуют образованию доменных стенок. Тем не менее, когда размер частицы меньше определенного значения, условия для формирования доменных стенок становятся неблагоприятными, и каждая частица образует отдельный домен. Именно это и происходит с суперпарамагнитной наночастиц. Суперпарамагнетизм необходим при доставке лекарственных препаратов, так как после прекращения воздействия магнитного поля намагниченность исчезает (если не принимать в расчет остаточную намагниченность и коэрцитивную силу (рис. 3.)), предотвращая, таким образом, скапливание частиц (и возможную закупорку капиллярных сосудов).
Другим основным требованием является способность к биологическому разложению или выведению в неприкосновенности магнитного ядра. Так, SPION считается поддающимся биологическому разложению, поскольку железо перерабатывается или повторно используется клетками с помощью обычных биохимических механизмов метаболизма железа. Те ядра, которые нельзя подвергнуть биологическому разложению, нуждаются в специальном покрытии для того, чтобы избежать воздействия (и возможного выщелачивания) магнитного ядра и облегчить целостное выделение через почки так, чтобы время жизни вещества в крови определялось скоростью фильтрации.
Покрытия на магнитных наночастицах
Покрытия на магнитных наночастицах обычно служат нескольким целям. Уже упоминалось их значение для уменьшения выщелачивания ядер. Наличие покрытия также часто облегчает стабилизацию наночастиц в окружающей среде со слегка щелочным показателем pH или существенной концентрацией соли. Например, изоэлектрическая точка SiO2 достигается при pH 2-3, что означает, что покрытые двуокисью кремния наночастицы отрицательно заряжены при водородном показателе крови, а это вызывает электростатическое отталкивание, которое позволяет избегать образования скоплений.
У покрытий из двуокиси кремния имеются и дополнительные преимущества. С одной стороны, внешняя поверхность покрытия из двуокиси кремния может приобрести функциональное значение, обеспечивая возможность связывания молекул. Это, в основном, связано с наличием поверхностных гидроксильных групп в существенных концентрациях, которые обеспечивают внутренне присущую гидрофильность и возможность присоединения на поверхности некоторых биомолекул с помощью ковалентных связей. С другой стороны, внутренняя пористость двуокиси кремния может быть использована для размещения специального лекарственного препарата, этого можно достигнуть, если избежать нежелательной физической адсорбции более крупных молекул. Так как самым маленьким основным белком в сыворотке крови является сывороточный альбумин, молекулярная масса которого равна примерно 66 000 Da при эффективном сферическом радиусе примерно в 40 Å. Это означает, что альбуминовая сыворотка и более крупные молекулы будут исключены из каналов микропористых и мезопористых (с размерами пор <4 нм) покрытий (например, двуокись кремния, углерод, цеолиты) на магнитных ядрах. И, наконец, двуокись кремния, и прочие микропористые неорганические материалы огнестойки, они обладают гладкими поверхностями и хорошей механической прочностью. На рисунках 4 и 5 показаны различные типы неорганических покрытий на металлических ядрах.

Рис. 4. Полученные с помощью трансмиссионной электронной микроскопии с высоким разрешением (HRTEM) изображения (a) магнетитовой наночастицы, инкапсулированной в двуокиси кремния; (b) магнетитовой наночастицы, встроенной в цеолитовую (алюминосиликатную) матрицу; (c) наночастиц железа, инкапсулированных в двуокиси кремния; (d) магнетитовой наночастицы, инкапсулированной в графите.

Рис. 5. Полученные с помощью трансмиссионной электронной микроскопии с высоким разрешением (HRTEM) фотографии: (a) магнетитовой наночастицы, инкапсулированной в двуокиси кремния; и (b) полученной с помощью EFTEM карты цветов наночастиц золота, инкапсулированных в двуокиси кремния.
Кроме того, покрытия играют существенную роль в препятствовании очищению с помощью РЭС. В зависимости от размера, функциализации поверхности и гидрофильности, быстрое внедрение наночастиц без покрытия мононуклеарной фагоцитной системой (MPS) наиболее вероятно после системного применения, за которым следует очищение печени, селезенки и костного мозга. Различные белки (антитела) сыворотки крови связываются с поверхностями инородных тел, ускоряя поглощение частиц. Для того чтобы избежать этого, можно использовать поддающийся биологическому разложению (например, декстран) и не поддающиеся биологическому разложению органические и неорганические покрытия в качестве средств, задерживающих обнаружение и поглощение макрофагами РЭС. Возможно наиболее широко используемым для этих целей покрытием является ПЭГ (полиэтиленгликоль), линейный нейтральный полиэфир, чье присоединение к поверхностям наночастиц обеспечивает ‘скрытый’ экранирующий эффект и задерживает действие РЭС. ПЭГ обладает низкой токсичностью и иммуногенностью, здесь также возможно выведение в неповрежденном виде. То, что он может избегать обнаружения РЭС, становится возможным благодаря устойчивости поверхностей, покрытых полиэтиленгликолем, к белкам, которую принято считать результатом сочетания низкой энергии межфазного взаимодействия в воде и воздействия пространственной стабилизации. К сожалению, функция «скрытого» иммунного воздействия, которое осуществляет ПЭГ, часто сочетается с потерей способности к биомолекулярному целевому воздействию; в этой связи, возникает необходимость оптимизировать покрытие.
Характер покрытия также очень важен в случаях, когда приобретение поверхностью функций может вызвать связывание водорода и, вследствие этого, скопление наночастиц. Для таких ситуаций уменьшение скопления частиц и повышение стабильности наночастиц в жидкостях организма возможны с помощью модификации поверхности.
Большое количество молекул было загружено в органические и неорганические оболочки, например, с помощью химической функционализации или физической абсорбции. В этот список входят частицы, распознающие опухоли, такие как антитела в ‘разумных’ контрастных веществах и проникающие в клетки белки для применения в магнитно-резонансной томографии; и энзимы, токсины, гены (трансфекция), факторы роста, радионуклиды, фолиевая кислота, и лекарственные препараты.
М. Арруэбо, Р. Фернандес-Пачеко, М. Ибарра и Х. Сантамария, Нанонаучный Институт Арагона (INA), Университет Сарагосы, Испания
http://www.nanotoday.com