Химия растворов - большой энергетике
Современная энергетика преимущественно тепловая и базируется на невозобновляемых источниках, углеводородах и уране. Доля прочих источников в энергетике – гидроресурсы, ветер, солнце – невелика. Существующие способы преобразования тепловой энергии в электрическую основываются на пароводяных термодинамических циклах, коэффициент полезного действия которых не превышает 63%. Однако реальны многообещающие способы серьезного повышения КПД циклов преобразования энергии при снижении рабочих температур, и решающее слово тут принадлежит химии растворов и мембранным технологиям.
Об авторах:
Андрей Иванович Пелипенко (1967 г. р.) – инженер-механик; в 1989 г. окончил "ВИКИ им А.Ф. Можайского" по специальности «летательный аппарат и технологическое оборудование» (тематика диплома - двигательная установка). После окончания института работал на инженерных должностях в ВС СССР, а позже – на гражданских предприятиях и в учреждениях России.
Николай Дмитриевич Колисниченко (1962 г. р.) – в 1981 г. окончил Днепропетровский техникум автоматики и телемеханики по специальности «техник-математик-программист»; в 1990 г. – Хабаровский политехнический институт по специальности «инженер-экономист». Работал на экономических, инженерных, руководящих должностях в банках и на частных предприятиях, занимался преподавательской деятельностью.
Современная энергетика – преимущественно тепловая и базируется на источниках, запасы которых ограничены (к примеру, уголь), а то и просто подходят к концу, как мировые запасы нефти и урана. Доля прочих источников в энергетике – гидроресурсы, ветер, солнце – невелика, и увеличение этой доли не предвидится по многим причинам (в данной статье они рассматриваться не будут). Перспективные термоядерные реакторы все еще находятся в стадии разработки, и цена производимой ими электроэнергии будет весьма высока.
Существующие способы преобразования тепловой энергии в электрическую основываются на пароводяных термодинамических циклах, коэффициент полезного действия которых находится в пределах: 30% – для атомных, 52% – для угольных (высокотемпературные котлы высокого давления) и 63% – для комбинированных турбокотловых циклов на природном газе. Таким образом, не менее 37% тепловой энергии, заключенной в топливе, просто выбрасывается наружу.
Однако реальны многообещающие способы серьезного повышения КПД циклов преобразования энергии при снижении рабочих температур, и решающее слово тут принадлежит химии растворов и мембранным технологиям.
Особенностью растворения кристаллических и других веществ в воде и прочих растворителях являются относительно небольшие тепловые эффекты при наличии осмотического давления, зачастую очень большого. Следует напомнить, что осмотическое давление – это термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия - осмотическое всасывание растворителя через мембрану в раствор. Оценить это давление можно по закону Вант-Гоффа, и оно прямо пропорционально зависит от температуры раствора, чем температура выше, тем давление больше. Причем важно отметить, что в процессе растворения величины тепловых эффектов в десятки и сотни раз меньше тепловых затрат, требуемых на испарение самого растворяемого вещества, например соли. Тепловые эффекты выделения растворяемых веществ из растворов те же, что и при растворении, но с обратным знаком. Словом, если вещество растворялось с выделением тепла, то при его выделении из раствора тепло будет поглощаться, и наоборот. Таким образом, использование осмотического давления в устройствах генерации энергии оказывается намного более выгодным именно в силу незначительности потерь тепла, которое следует сбросить в окружающую среду на низкотемпературной части цикла, для того чтобы получить исходное растворимое вещество и растворитель из раствора.
Поясним кратко принцип работы такого цикла, для иллюстрации возьмем обычную поваренную соль – NaCl. Для того чтобы испарить килограмм ее кристаллов, потребуется очень большое количество тепла, но, растворяясь в воде, она поглотит совсем небольшое количество тепла, в чем может убедиться каждый у себя дома, впрочем, сказанное относится и к сахару тоже. Согласно закону Вант-Гоффа, осмотическое давление численно равно давлению, которое оказало бы растворённое вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора.
Для организации цикла потребуются две мембраны, которые будут пропускать воду, но не будут пропускать соль. Итак, возьмем две емкости, связанные трубками; емкости разделены мембранами, рис. 1.
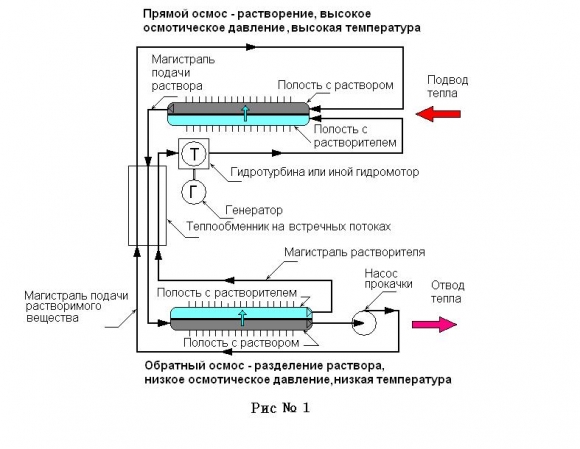
Контур генерации
По одну сторону мембран находится соль в воде, по другую – чистая вода; отсеки с солью в емкостях связаны между собой трубкой, так же как и отсеки с водой. Никакого движения не происходит, поскольку каждый из насыщенных растворов пытается затянуть воду на свою сторону через мембрану с одинаковой силой (осмотические давления равны). Теперь поместим одну из емкостей в лед, а вторую – нагреем. Обнаружим, что раствор и вода начнут перемещаться по собранному нами контуру, а соль постепенно перекочует из емкости с высокой температурой в емкость с низкой.
Происходит это потому, что осмотическое давление раствора при высокой температуре выше, чем при низкой, и из раствора в низкотемпературной емкости сквозь мембрану будет выдавливаться вода, поскольку местное осмотическое давление насыщенного раствора тут ниже. В результате образуется поток раствора из высокотемпературной емкости в низкотемпературную. Остается только: организовать подачу соли из низкотемпературной емкости в высокотемпературную (или просто время от времени менять их ролями); включить в трубку с водой или раствором гидромотор; сами трубки поместить во встречный теплообменник, где вода будет нагреваться, а раствор остывать во встречном движении. Обращаем внимание, что для работы такого цикла преобразования энергии не используется пар, а следовательно, не нужна дорогая и сложная в изготовлении паровая турбина, достаточно гидромотора или гидротурбины.
Однако имеется возможность значительно улучшить даже и эту схему. Все дело в том, что разные вещества растворяются с разными тепловыми эффектами, причем зачастую создаваемые ими осмотические давления существенно отличаются от теоретически предсказанных законом Вант-Гоффа. Есть вещества, требующие для своего растворения довольно большой теплоты и при этом создающие малое осмотическое давление, и вещества, требующие при растворении малой теплоты, но создающие большее осмотическое давление. Связано это с особенностями диссоциации веществ в конкретном растворителе.
Либо, имея при растворении один и тот же тепловой эффект, растворы могут создавать разные осмотические давления. Таким образом, если использовать пару таких растворов с одним и тем же растворителем и свести их в общий контур, то можно получить систему, преобразующую тепловую энергию в электрическую с коэффициентом полезного действия, превышающим 85%. Хотя ничто не мешает создать установку и на раздельных контурах с разными растворителями, связать их между собой теплообменниками и передачей механической энергии.
Кратко поясним работу такой схемы, рис. 2.
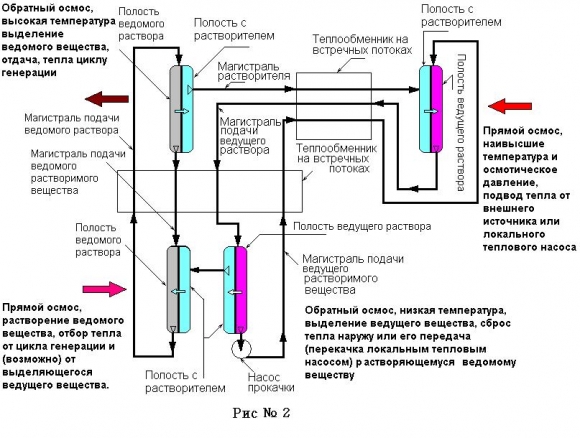
Контур теплового насоса с разнесением камер по температуре.
Упомянутые на схеме и не показанные локальные тепловые насосы целесообразны при низких теплоперепадах в несколько градусов.
Итак, имеем два вещества с разными тепловыми эффектами и близкими осмотическими давлениями. Если соединить два таких раствора селективной мембраной, пропускающей только растворитель, то растворитель не будет перемещаться между этими растворами. Теперь трубками соединим две такие емкости с мембранами так, что емкости с раствором одного типа будут связаны такой трубкой; сами емкости будут находиться при разных температурах. Никакого движения растворителя не будет, и нам придется задействовать насос. Но обратим внимание на то, что энергия, потребляемая этим насосом, крайне мала по сравнению с тепловой энергией, которую сможет передать такой насос на высокотемпературной стороне. Дело в том, что насосу придется просто преодолеть сопротивление мембран, для чего нужно создать давление в несколько атмосфер. Иными словами, отопительный коэффициент будет очень велик, а температурный перепад может составить до 100-150°С, или больше. Такой перепад позволит организовать термодинамический цикл с применением генерирующего осмотического контура, как это было сказано выше. Но емкости с растворами не обязательно должны соединяться друг с другом через одну мембрану, их можно соединить и через две мембраны и трубки, проводящие растворитель, а это позволит разнести емкости по температуре, как на верхнем температурном уровне, так и на нижнем. Такой прием может компенсировать небольшие разницы в осмотических давлениях, либо избавиться от дополнительного генерирующего контура, включив гидромотор непосредственно в контур.
Возможно создать много разных способов реализации такого рода термодинамических циклов. Все выгоды их применения достаточно очевидны. Например, Франция, 80% энергетики которой обеспечивается ядерными электростанциями, сможет практически удвоить свой энергетический потенциал без строительства новых электростанций, просто за счет увеличения КПД имеющихся. Такие системы могут быть выгодно применены для генерации энергии везде, где имеется бросовое или дешевое низкотемпературное тепло, например на химических предприятиях (для внутренних нужд или в установках синтеза метанола и т.п.).
На данный момент никаких аналогов подобным разработкам в мире не выявлено; разработка находится в стадии теоретических исследований и нуждается в финансировании для продолжения лабораторных исследований и постройки опытного образца. Идея принадлежит частным лицам, поданы заявки на предполагаемые изобретения по данной тематике.
Energy-of-membranes@yandex.ru
Energy-of-membranes@ya.ru
Energy-of-membranes@narod.ru