Исходя из максимального количества α-кислорода, которое может быть «посажено» на данном образце цеолита (уравнение 26), рассчитывается концентрация α-центров Сα в предположении, что один атом кислорода занимает один центр. Значения Сα, определенные разными методами, хорошо согласуются между собой [85]. Для наиболее активных образцов с достаточно высоким содержанием железа величина Сα может достигать 100 мкмоль/г. Изучению свойств α-кислорода посвящено значительное число работ, результаты которых рассмотрены в обзоре [86]. Особенно следует отметить низкую энергию связи Оα с поверхностью и очень высокую реакционную способность, благодаря которой он способен уже при комнатной температуре окислять различные углеводороды. В работах [81, 82, 87] предложена квантовохимическая модель активных центров, позволяющая описать особенности α-кислорода. Отметим, что α-кислород не образуется при адсорбции О2.Стехиометрическая реакция бензола с α-кислородом Установление специфической способности закиси азота генерировать α-форму поверхностного кислорода подводит нас к главному вопросу относительно механизма реакции, а именно, к вопросу об участии α-кислорода в образовании фенола.
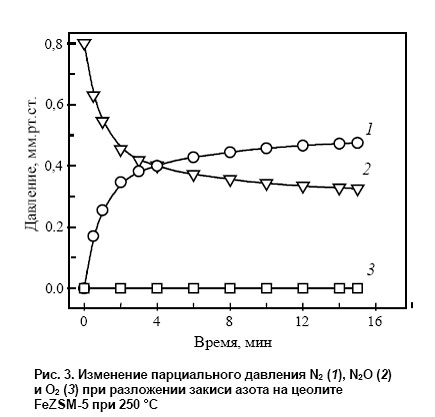
Согласно общепринятой точке зрения, которая особенно ясно сформулирована в работах школы Борескова применительно к классическим оксидным катализаторам [88], поверхностный кислород, участвующий в парциальном окислении, не должен обладать
низкой энергией связи с поверхностью и не должен иметь высокую реакционную способность, что находится в явном противоречии со свойствами α-кислорода. Поэтому идея соотнести образование фенола с генерацией α-кислорода требует серьезного экспериментального подтверждения. Следует отметить, что идентификация поверхностных форм кислорода, принимающих участие в реакциях окисления, представляет собой очень трудную задачу. В условиях катализа при повышенных температурах происходят быстрые взаимные превращения различных форм кислорода [89, 90], что делает результаты малоинформативными. При пониженной температуре, когда таких превращений нет, идентификацию поверхностных форм кислорода обычно также не удается провести либо из-за их низкой активности, либо из-за малой концентрации. В случае же α-кислорода ситуация кажется уникальной- высокая активность и большая концентрация этой формы кислорода, которую можно регулировать (путем введения Fe) в пределах нескольких порядков. Это обстоятельство позволило нам простым и надежным способом ответить на вопрос об участии α-кислорода в реакции окисления бензола [85] Сущность экспериментов заключалась в титровании α-кислорода бензолом, которое проводилось по схеме, включающей «посадку» кислорода на α-центр, его взаимодействие с бензолом при комнатной температуре и экстракцию продукта метанолом: 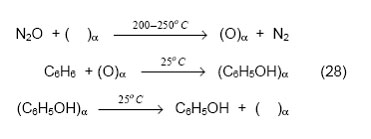
Как показали исследования, в пределах точности эксперимента выход фенола близок к теоретическому. Других продуктов реакции не обнаружено. Полученные результаты, несомненно, говорят об участии α-кислорода в образовании фенола. Позднее этот вывод был подтвержден дополнительными экспериментами с использованием α-кислорода, обогащенного изотопом 18О. Биомиметические свойства α-кислорода
| 