Специфика действия N2O как окислителя 
Специфика закиси азота как окислителя - это один из наиболее важных вопросов, возникающих при исследовании реакции окисления бензола в фенол. Преимущества закиси азота по сравнению с O2 наглядно демонстрируют результаты, представленные в табл. 2. 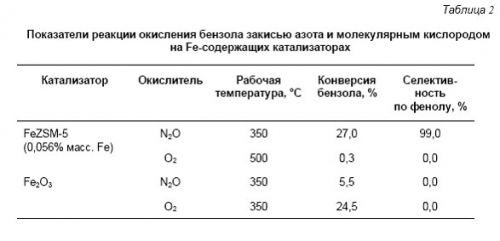
Естественно предположить, что столь сильное влияние природы окислителя связано с существенным изменением в состоянии поверхностного кислорода. Это предположение стимулировало постановку ряда работ по исследованию механизма реакции разложения закиси азота на цеолитах FeZSM-5, поскольку именно за счет этой реакции осуществляется поставка кислорода на поверхность катализатора. Исследования позволили установить, что разложение N2O протекает на α-центрах цеолита с образованием новой формы поверхностного кислорода, условно названной α-кислородом [84, 85]. В низкотемпературной области реакция образования α-кислорода носит стехиометрический характер:N2O + ( )α = (O)α + N2(26) На рис. 3 приведена кинетическая кривая низкотемпературного разложения N2O в статической установке. Видно, что протекание реакции сопровождается выделением в газовую фазу только N2, тогда как образующийся кислород заполняет α-центры и остается полностью связанным на поверхности. По мере заполнения α-центров реакция прекращается. До температуры 300 оС α-кислород термически устойчив. Выше этой температуры он необратимо десорбируется в газовую фазу и реакция разложения N2O приобретает
характер обычного каталитического процесса. Для проведения дальнейших количественных исследований важно знать концентрацию α-кислорода. Существует несколько методов, позволяющих надежно определить данную величину. Это может быть выполнено как путем непосредственного измерения количества выделившегося N2 (или израсходованного N2O) в ходе реакции (26) или путем десорбции Оα в газовую фазу при нагревании образца выше 300 оС. Кроме того, удобно использовать реакцию изотопного обмена, в которую α-кислород легко вступает уже при комнатной температуре: (16O)α + 18O2 = (18O)α + 16O18O (27) В состоянии равновесия доли изотопа 18О в поверхностном α-кислороде и в кислороде газовой фазы равны, что позволяет рассчитать количество Оα, вступившего в обмен. Собственный кислород цеолита инертен в отношении изотопного обмена и не мешает измерению концентрации α-кислорода.
| 