|
АЗОТНАЯ КИСЛОТА HNO3, мол. м. 63,016, бесцв. жидкость
(см. табл.). Сильная одноосновная к-та (рКа —1,64). Молекула
имеет плоскую структуру (длины связей в нм):
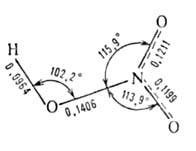
Твердая А. к. образует две кри-сталлич. модификации-с моноклинной и
ромбич. решетками. Конц. к-та малоустойчива, при нагр. или под действием
света частично разлагается: 4HNO3 -> 4NO2 + 2H2O
+ O2; образующийся NO2 окрашивает к-ту в бурый цвет
и придает ей специ-фич. запах.
СВОЙСТВА АЗОТНОЙ КИСЛОТЫ И LE КРИСТАЛЛОГИДРАТОВ
|
Показатель
|
HNO3
|
Моногидрат
|
Тригидрат
|
|
Плотн., г/см3 .......
|
1,513
|
_
|
_
|
|
Т. пл., °С ........
|
-41,59 (82.6)*
|
-37,62
|
-18,47
|
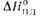
кДж/моль . . . . . |
10,47
|
17,50
|
29109
|
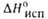
(293 К), кДж/моль . . |
39.1
|
—
|
—
|
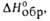
кДж/моль . . . . . |
-174,1 (_ 134,9)**
|
-473,5
|
-1056,1
|
|
С°р (300 КХ Дж/(моль*К)
. .
|
109,9 (54,22)**
|
182
|
325
|
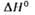
растворения в воде, кДж/моль ....... |
-33.68
|
-19.82
|
-8,92
|
|
S0298, Дж/(моль*К) .
. . . .
|
155,6 (266,9)**
|
217
|
344
|
* Т-ра кипения. ** Для газа при 298 К.
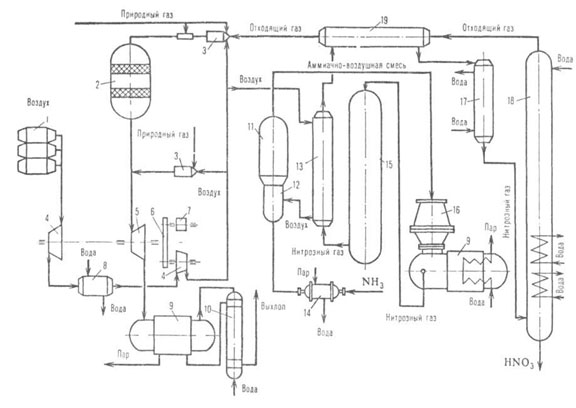
Рис. 1. Схема произ-ва азотной к-ты под единым давлением (0,65-0,70
МПа): 1-воздушный фильтр; 2-реактор каталитич. очистки отходящего газа;
3-камера сгорания; 4-воздушный компрессор; 5-газовая турбина; 6-редуктор;
7-электродвигатель; 8-промежут. холодильник; 9-котел-утилизатор; 10 -экономайзер;
11-поролитовый фильтр; 12-смеситель NH3 и воздуха; 13- подогреватель
воздуха; 14-испарителъ NH3; 15-аппарат для окисления NO; 16-контактный
аппарат для окисления NH3; 17 - холодильник-конденсатор; 18
- абсорбц. колонна; 19-подогреватель отходящего газа.
А. к. смешивается с водой во всех соотношениях. В водных р-рах практически
полностью диссоциирует на Н+ и NO-3. Образует
с водой азеотропную смесь (68,4% по массе HNO3; т. кип. 120,7°С,
d2041,41),
моно- и тригидраты. Для водных р-ров d204составляет
1,0543 (10%-ная к-та), 1,1150 (20%-ная), 1,3100 (50%-ная), 1,4134 (70%-ная),
1,4826 (90%-ная). Для 49,94%-ного р-ра парциальное давление HNO3 и
воды составляет (в Па) соотв. 47,91 и 1030,75, для 69,7%-ного-383,04 и
388,36, для 96,48%-ного-5531,47 и 14,63. А. к. ограниченно раств. в эфире.
А. к.-сильный окислитель. Под действием А. к. металлы (за исключением
Pt, Rh, Ir, Nb, Zr, Та, An) превращаются в нитраты или оксиды, сера энергично
окисляется в H2SO4, фосфор-в Р2О5,
орг. соед. окисляются и нитруются. Стойкость конструкц. материалов к А.к.
определяется св-вами поверхностных оксидных пленок. В разб. А. к. стойки
хромо-никелевые стали, Ti, в концентрированной-чистый А1, высококремнистый
чугун, хромо-никель-кремниевые стали. Титан в среде конц. А. к., содержащей
растворенные оксиды азота, приобретает пирофорные св-ва. В А. к. любой
концентрации стойки стекло, кварц, фторопласт-4.
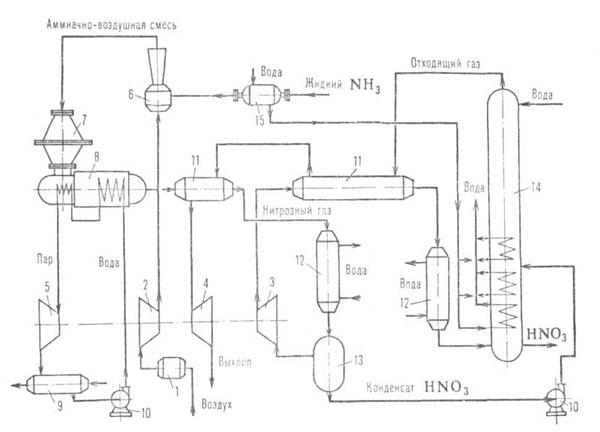
Рис. 2. Схема произ-ва азотной к-ты с двумя ступенями давления (окисление
NH3 при 0,35 МПа, абсорбция МО2 при 0,8 МПа): 1-фильтр
воздуха; 2-воздушный компрессор; 3- компрессор нитрозного газа; 4 -газовая
турбина; 5 -паровая турбина; 6-смеситель NH3 и воздуха; 7-контактный
аппарат для окисления NH3; 8-котел-утилизатор; 9-конденсатор;
10-насос; 11-подогреватель отходящего газа; 12 -холодильник-конденсатор;
13-сепаратор; 14-абсорбц. колонна; 15-испаритель NH3.
Для практич. целей используют 30-60%-ные водные р-ры А. к. или 97-99%-ные
(конц. А. к.). Смесь концентрированных азотной и соляной к-т (соотношение
по объему 1 :3) наз. царской водкой; она растворяет даже благородные металлы.
Смесь HNO3 концентрации ок. 100% и H2SO4
концентрации ок. 96% при их соотношении по объему ок. 9:1 наз. меланжем.
Пром. методы получения разб. HNO3 включают след. стадии:
получение NO, окисление его до NO2, абсорбцию NO2
водой, очистку отходящих газов (содержащих в осн. N2) от оксидов
азота. Осн. способ получения NO заключается в окислении NH3
кислородом воздуха в присут. катализатора: 4МН3 + 5О2
-> 4NO + 6Н2О + 907,3 кДж. Катализатор-сетка из сплавов Pt (80-95%)
с металлами платиновой группы. В СССР используется двухступенчатый катализатор
(первая ступень-платиновые сетки, вторая-оксидный неплатиновый катализатор),
позволяющий сократить кол-во загружаемой платины на 40-60%. Потери Pt при
одноступенчатом катализаторе, в осн. из-за мех. уноса, составляют (г Pt
на 1 т HNO3): 0,05 при 0,1 МПа, 0,1 при 0,4 МПа, 0,15 при 0,7
МПа. При использовании двухступенчатого катализатора потери Pt снижаются
на 15-25%.
Окисление NO (2NO + О2 ->2NO2 + 124 кДж) протекает
в газовой фазе при охлаждении нитрозного газа (полученного на стадии окисления
NH3) до 160-250°С; ниже 100°С идет димеризация (2NO2
-> N2O4 + 56,9 кДж/моль). Абсорбцию NO2
водой (3NO2 + H2O->2HNO3 + NO + + 136,2
кДж/моль) осуществляют в тарельчатых колоннах со значит. межтарелочными
объемами. Отходящий газ содержит 0,02-0,15% по объему оксидов азота, 2-5%
О2 и N2; при содержании остаточных оксидов азота
более 0,02% проводят их каталитич. восстановление до N2. В случае
восстановления аммиаком (кат.-оксиды А1 и V; 250-300СС) происходят
р-ции:
3NO + 2NH3 -> 2,5N2 + ЗН2О 3NO2
+ 4NH3 -> 3,5N2 + 6H2O
Отходящий газ очищают также на алюмопалладиевом кат. (т-ра начала р-ции
350-500°С) с использованием в кач-ве восстановителя прир. газа:
СН4 + 2О2 -> СО2 + 2Н2О
+ 802 кДж СН4 + 2NO2 -> N2 + 2H2O
+ СО2 + 868 кДж СН4 + 4NO -> 2N2 + 2Н20
+ СО2 + 1160кДж
Установки по произ-ву разб. HNO3 (см. рис. 1 и 2) характеризуются
высокой производительностью (350-1400 т/сут), полнотой использования теплоты
хим. р-ций, экономным расходованием сырья и вспомогат. материалов.
Конц. А. к. получают двумя осн. способами. Первый заключается в ректификации
тройных смесей, содержащих HNO3, воду и к.-л. водоотнимающее
в-во, обычно H2SO4 или Mg(NO3)2.
В результате получают пары 100%-ной HNO3, к-рые конденсируют,
и водные р-ры водоотнимающего агента. Последние упаривают и возвращают
в произ-во. Второй способ основан на р-ции: 2N2O4M
+ + 2Н2О(ж) + О2(г)->4НNO3(ж) + 78,8 кДж
("ж"-жидкость, "г"-газ). При давлении ок. 5 МПа и использовании чистого
О2 образуется 97-98%-ная HNO3, содержащая до 30%
по массе растворенных оксидов азота. А. к. получают разгонкой этого р-ра.
При 0,7-1,0 МПа и использовании воздуха образуется 80-85%-ная HNO3
и азеотропная смесь А. к. с водой. Жидкий N2O4 получают
гл. обр. путем растворения NO2, содержащегося в нитрозном газе,
80-100%-ной HNO3 с послед. разгонкой этого р-ра и конденсацией
жидкого N2O4.
А. к. особой чистоты производят ректификацией 97-98,5%-ной HNO3
в аппаратуре из силикатного или кварцевого стекла. Содержание примесей
в такой к-те менее 1 * 10-6% по массе.
Метод получения А.к., основанный на взаимод. N2 и О2
воздуха
выше 2200°С (N2 + О2 -> 2NO + 180,6 кДж) с послед.
быстрым охлаждением NO, его окислением и абсорбцией NO2 водой,
распространения пока не получил.
Осн. кол-во разб. HNO3 расходуется в произ-ве NH4NO3
и
сложных минер. удобрений, нитратов Na, К, Са и др., в гидрометаллургии.
Конц. к-та используется при получении ВВ, H2SO4,
H3PO4, ароматич. нитросоединений, красителей, входит
в состав ракетного топлива. А. к. используется также для травления металлов,
полупроводниковых материалов и др.
Произ-во А. к. взрывоопасно из-за использования в нем горючих и взрывоопасных
B-B-NH3 и прир. газа. Под действием А. к. воспламеняются бумага,
масло, древесина, уголь. При попадании на кожу она вызывает ожоги. Аммиак,
пары HNO3, оксиды азота токсичны. ПДК паров HNO3
и оксидов азота 2 мг/м3 (в пересчете на NO2). Произ-во
А.к. в развитых кап. странах ок. 22 млн. т (1982).
===
Исп. литература для статьи «АЗОТНАЯ КИСЛОТА»: Справочник азотчика, под ред. Н. А. Симулина [и др.], т.
2, М., 1969; А трощен ко В. И., Каргин С. И., Технология азотной кислоты,
М., 1970; Производство азотной кислоты в агрегатах большой единичной мощности,
под
ред. В. М. Олевского, М., 1985. А. А. Солоха.
Страница «АЗОТНАЯ КИСЛОТА» подготовлена по материалам химической энциклопедии.
|

