|
БРОМ (от греч. bromos - зловоние; название связано с неприятным
запахом Б.; лат. Bromum) Br, хим. элемент VII гр. периодич. системы, ат.
н. 35, ат. м. 79,904; относится к галогенам. Прир. Б. состоит из
стабильных изотопов 79Вr (50,56%) и 81Вr (49,44%).
Конфигурация внеш. электронной оболочки 4s24p5; степени
окисления — 1 (бромиды), + 1 (гипобромиты), + 3 (бромиты), + 5 (броматы)
и + 7 (перброматы); энергия ионизации при последоват. переходе от Вг° до
Вг7+ соотв. 11,84, 21,80, 35,90, 47,3, 59,7, 88,6, 109,0, 192,8
эВ; электроотрицательность по Полингу 2,8; атомный радиус 0,119 нм, ионные
радиусы Вr- (6), Br3+ (4), Br5+ (3), Br7+
(6X Вг7+ (4) соотв. 0,182, 0,073, 0,045, 0,053, 0,039 нм (в
скобках указано координац. число).
Молекула Б. двухатомна (в парах обнаружены молекулы Вr4),
длина связи в молекуле 0,228 нм; энергия диссоциации 190,0 кДж/моль, степень
диссоциации 0,16% при 800°С и 18,3% при 1284°С
Содержание Б. в земной коре 1,6*10-4 % по массе (1015-1016
т). Собственно минералы бромаргирит AgBr и эмболит Ag(Cl, Br) редки. Б.
находится в природе в рассеянном состоянии, являясь постоянным спутником
хлора. Соли Б. легко выщелачиваются и накапливаются в морской воде (0,065%
по массе), рассолах соляных озер (до 0,2%) и в подземных рассолах (до 0,1%),
обычно связанных с соляными и нефтяными месторождениями. В виде изоморфной
примеси Б. содержится в поваренной соли NaCl (0,005-0,03% по массе), сильвине
КС1 (0,02-0,1%), карналлите КМgС13*6Н2О (0,1-0,39),
бишофите MgCl2*6H2O (до 0,6%).
Свойства. При обычных условиях Б. - тяжелая жидкость с резким
запахом, в отраженном свете темно-фиолетового, почти черного цвета, в проходящем
- темно-красного; легко образует желто-бурые пары; т. пл. - 7,25 °С, т.
кип. 59,2 °С. Твердый Б. - красно-коричневые игольчатые кристаллы со слабым
металлич. блеском, к-рые при — 252 °С становятся бесцветными. Б. кристаллизуется
в ромбич. системе, а = = 0,448 нм, b = 0,667 нм, с = 0,872
нм, z = 4, пространств. группа Сета. Плота, твердого Б. 4,073
г/см3 ( — 7,3 °С), жидкого - 3,1055 г/см3 (25°С);
tкрит 315°С, ркрит 10,0 МПа, dкрит 1,26
г/см3; ур-ние температурной зависимости давления пара над жидким
Б.: lgp(Ha) = -2047,75/T - 0,0061007 + 0,9589*lg T+ 10,76568; С°р
75,69 Дж/(моль*К);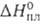 10,58 кДж/моль,
10,58 кДж/моль,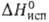 30,86 кДж/моль; So298 152,0, для газообразного 245,37
Дж/(моль*К); температурный коэф. объемного расширения 11,0*10-4
К-1 (273-332 К); теплопроводность 4,5 (25°С), газообразного
0,21 Вт/(м*К) при 59°С;
30,86 кДж/моль; So298 152,0, для газообразного 245,37
Дж/(моль*К); температурный коэф. объемного расширения 11,0*10-4
К-1 (273-332 К); теплопроводность 4,5 (25°С), газообразного
0,21 Вт/(м*К) при 59°С;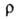 7,69*1012 Ом*см;
7,69*1012 Ом*см;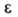 3,148; стандартный электродный потенциал в водном р-ре (Вr2/Вr-)
+ 1,065 В; ур-ние температурной зависимости вязкости для жидкого Б.:
3,148; стандартный электродный потенциал в водном р-ре (Вr2/Вr-)
+ 1,065 В; ур-ние температурной зависимости вязкости для жидкого Б.: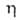 = 1,241*10-3 (1 + 0,01225t + 2,721*10-6t2)
(Па*с);
= 1,241*10-3 (1 + 0,01225t + 2,721*10-6t2)
(Па*с);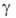 1,5*10-3
Па (20°С). Молекулярный Б. диамагнитен. Для спектра Б. характерна широкая
полоса поглощения в видимой и УФ-области с максимумом при 420 нм; nD15
1,659. 1,5*10-3
Па (20°С). Молекулярный Б. диамагнитен. Для спектра Б. характерна широкая
полоса поглощения в видимой и УФ-области с максимумом при 420 нм; nD15
1,659.
Б. раств. в воде (3,58 г в 100 г при 20 °С), в присут. хлоридов и особенно
бромидов р-римостъ повышается, а в присут. сульфатов понижается; ниже 5,84°С
из водных р-ров осаждаются гранатово-красные кристаллы октагидрата. Р-римость
воды в жидком Б. составляет 0,05% по массе. В водных р-рах Б. частично
гидролизуется: Вг2 + Н2О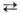 _Н+
+ Вг- + НВrO; константа равновесия Кр = 5,8*10-9
(25°С). Насыщенный водный р-р Б. в воде наз. бромной водой. В конц. H2SO4
и Н3РО4 Б. раств. слабо. В р-рах щелочей на холоду
образует бромид и гипобромит соответствующего металла, а при повышенных
т-рах - бромид и бромат. Б. смешивается во всех отношениях с большинством
орг. р-рителей. _Н+
+ Вг- + НВrO; константа равновесия Кр = 5,8*10-9
(25°С). Насыщенный водный р-р Б. в воде наз. бромной водой. В конц. H2SO4
и Н3РО4 Б. раств. слабо. В р-рах щелочей на холоду
образует бромид и гипобромит соответствующего металла, а при повышенных
т-рах - бромид и бромат. Б. смешивается во всех отношениях с большинством
орг. р-рителей.
По реакц. способности Б. занимает промежут. положение между С12
и 12. С др. галогенами образует неустойчивые BrF3
(т. пл. 8,8°С, т. кип. 127 °С), BrF5 (т. пл.-61,3°С, т. кип.
40,5°С), BrCl (т. пл. ок.-66°С, т. кип. ок.-5°С с разл.) и IBr (т. пл.
41 °С, т. кип. 116°С), отличающиеся высокой хим. активностью (см. Межгалогенные
соединения). С О2 и N2 Б. непосредственно не
реагирует даже при повышенных т-рах, его нестойкие соед. с этими элементами
(Вr2О, ВгО2, Br3O8, NBr3*6NH3)
получают косвенными методами. Б. не реагирует также с углеродом. При взаимод.
с S, Se, Те, Р, As и Sb образуются соответствующие бромиды: S2Br2,
РВr3, РВr5, неустойчивые SeBr4 и Se2Br2,
TeBr4, AsBr3, SbBr3. Бор и Si образуют
с Б. при нагревании ВВг3 и SiBr4.
Нек-рые металлы (напр., К, А1) энергично взаимод. с сухим Б., но в большинстве
случаев из-за образования на пов-сти защитной пленки бромида, нерастворимого
в Б., р-ция энергично идет только в присут. воды, растворяющей пленку.
Стойки к действию Б. Pt и Та, в меньшей степени - Ag, Pb и Ti. С Н2
при нагр. Б. образует бромистый водород.
Б. - сильный окислитель, он окисляет в водных р-рах I-до
I, сульфиты и тиосульфаты - до сульфатов, нитриты - до нитратов, NH3
до N2. Ион Вr- в водных р-рах бромидов окисляется
С12, КМnО4, К2Сr2О7,
Н2О2 до Вr2. Из р-ций Б. с орг. соед.
Наиб. характерны присоединение по кратным связям и замещение водорода (обычно
в присут. кат. или при действии света). Ниже приводятся сведения о нек-рых
соед. Б.
Б. образует ряд кислородсодержащих к-т. Бромноватистая к-та НВгО существует
только в разбавл. водных р-рах; является слабой к-той (рКа
8,69); сильный окислитель; при стоянии диспропорционирует на НВr и
НВrО3, в присут. кат. (Pt, Fe) или под действием света разлагается
с выделением О2; получают гидролизом Вr2.
Бромистая к-та НВгО2 существует только в водных р-рах; в
течение 4 ч полностью разлагается; м.б. получена взаимод. AgNO3
с Вг2 в воде. Бромноватая к-та НВrO3 существует только
в водных р-рах, к-рые м. б. сконцентрированы в вакууме до концентрации
50%; при стоянии и нагревании разлагается; сильная к-та, окислитель; получают
при окислении Б. хлором в воде или разложением Ва(ВrО3)2
серной к-той. Бромная к-та НВrO4 известна в водных р-рах, к-рые
можно сконцентрировать в вакууме до концентрации 80%; при нагр. разлагается;
сильная к-та; в конц. р-рах сильный окислитель; м.б. получена пропусканием
р-ра КВrO4 через Н + -катионит.
Соли НВгО (гипобромиты) устойчивы в щелочных р-рах; при рН < 9 и
при нагр. превращаются в броматы; в щелочной среде являются сильными окислителями;
получают взаимод. Б. со щелочами на холоду. Гипобромит Na получают в виде
пента- и октагидратов, К-в виде тригидрата; желтые кристаллы; разлагаются
ок. 0°С; применяются в аналит. химии как реагенты для определения, напр.,
NH3, аминов. Соли НВrO2 (бромиты)-кристаллы; устойчивы
при обычных условиях; разлагаются при нагр.; в нейтральной среде - мягкие
окислители; получают взаимод. Б. со щелочами при строго контролируемых
рН, т-ре и концентрации; NaBrO2 -3H2O - желтые кристаллы;
обезвоживается в вакууме при 200°С; выше 200°С разлагается на NaBr и О2;
применяется для расшлихтовки тканей (удаления крахмала).
Соли НВrO3 (броматы) - бесцв. кристаллы; устойчивы при обычных
условиях; броматы щелочных металлов разлагаются при нагр. по схеме МВгО3
-> МВr + 1,5О2, др. металлов - по схеме М(ВrO3)2
-> МО + Вr2 + 2,5О2. Для NaBrO3 т. пл.
380°С; плотн. 3,34 г/см3; р-римость в воде (г в 100г)-36,4 (20°С),
90,8 (100°С). Для КВrO3 плотн. 3,25 г/см3; разлагается
при 400°С; р-римость в воде (г в 100 г)-6,9 (20°С), 49,7 (100°С). Броматы
Na и К получают электрохим. или хим. (действием С12) окислением
NaBr или КВr, а также взаимод. Б. с NaOH или КОН. Применяются в броматометрии.
Ва(ВrO3)2 кристаллизуется из водных р-ров в виде
дигидрата; раств. в воде (0,657 г безводной соли в 100 г при 20 °С); получают
обменной р-цией броматов щелочных металлов с BaCl; используется для получения
НВrO3.
Соли НВrO4 (п е р б р о м а т ы) - кристаллы, стабильны в
обычных условиях, выше 250°С разлагаются (напр., 2КВrO4 -> О2
+ 2КВrO3); хорошо раств. в воде; умеренные окислители; получают
окислением броматов Na или К фтором в щелочной среде.
Известны оксифториды Б. - сильные окислители и фторирующие агенты. Пербромилфторид
(триоксимонофторид брома) ВгО3F - бесцв. газ; т. пл.-110,35°С,
т. кип. 2,35°С; плотн. жидкости 2,2 г/см3; ур-ние температурной
зависимости давления пара: lgp (мм рт. ст.) = 17,6986 — -3048,45/Т (188-292
К); Нообр
137,4 кДж/моль, Нообр
137,4 кДж/моль,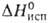 25,3 кДж/моль; Sо298 298,7 Дж/(моль*К). В отсутствие
влаги устойчив, в воде полностью гидролизуется до НВrО4 и HF.
Получают действием SbF5 на КВrО4 в среде плавиковой
к-ты.
25,3 кДж/моль; Sо298 298,7 Дж/(моль*К). В отсутствие
влаги устойчив, в воде полностью гидролизуется до НВrО4 и HF.
Получают действием SbF5 на КВrО4 в среде плавиковой
к-ты.
Бромилфторид (диоксомонофторид брома) ВrO2F - бесцв. летучая
жидкость; т. пл. - 9°С; для газа С° 62,898 Дж/(моль*К), S°298
294,11 Дж/(моль-К). Выше 52°С разлагается на BrF3, Вr2
и О2. В воде бурно гидролизуется до НВrO3 и HF. С
фторидами щелочных металлов дает соли с анионом ВrO2F2-,
с сильными к-тами Льюиса - соли с катионом бромила, напр. BrO2+SbF6-.
Получают р-цией BrF5 с КВrO3 в жидком HF или гидролизом
BrF5 при низких т-рах.
Окситрифторид брома (бромозил трифторид) ВrOF3 - бесцв. жидкость;
т. пл. ок. 0°С, при 25°С давление пара 6,65 Па. При комнатной т-ре медленно
разлагается на BrF3 и О2. С донорами иона F-
дает устойчивые кристаллич. соли типа K + BrOF4,
с акцепторами F- - соли с катионом OBrFI, напр. OBrF2+AsF6-.
Получают реакцией O2AsF6 с KBrOF4 или
действием KrF2 на BrO2F.
Получение. Для получения Б. используют морскую воду, озерные
и подземные рассолы, а также щелока калийного произ-ва (концентрация Б.
до 4-5 кг/м3), содержащие Б. в виде Вr-. Б. выделяют
пропусканием С12 с послед. отгонкой с водяным паром (при концентрации
Б. в р-ре более 1 кг/м3) или воздухом в насадочных колоннах
из керамики, стекла или Ti. Р-ры, имеющие щелочную р-цию, предварительно
подкисляют (обычно H2SO4) до рН 2,5-3,0. В верхнюю
часть колонны подается подогретый реакционный р-р, снизу - водяной пар
и неск. выше - С12. Пары, выходящие из колонны, конденсируют.
Далее Б. отделяют от воды и очищают от примесей С12 и орг. соед.
ректификацией. Применение воздуха вместо водяного пара позволяет использовать
р-ры с содержанием Б. менее 1 кг/м3. Р-р после обработки С12
подают в верхнюю часть колонны, снизу -воздух. Из образовавшейся бромвоздушной
смеси Б. улавливают р-ром FeBr2; получаемый при этом FeBr3
восстанавливают железными стружками до FeBr2. По др. способу
к бромовоздушной смеси добавляют SO2, к-рый в присут. паров
воды образует с Б. смесь НВг и H2SO4; Б. выделяют
действием С12. Для поглощения Б. могут быть использованы р-ры
NaOH или Na2CO3 (3Na2CO3 +
3Br2 = 5NaBr + NaBrO3 + ЗСО2). В этом
случае Б. выделяют действием H2SO4. Остаточный Б.
в отработанных р-рах обезвреживают Na2S2O3.
Определение. Качественно Б. обнаруживают по красно-фиолетовому
окрашиванию фуксина, розовому - эозина, желтому - слоя орг. р-рителя (напр.,
СС14), а также р-цией с флуоресцеином. Количеств. анализ осуществляют
иодометрически, аргентометрически, меркуриметрически, а также потенциометрич.
титрованием.
Применение. Б. используют для получения бромсодержа-щих неорг.
(напр., NaBr, КВг, НВг) и орг. соед. (ок. половины производимого Вr2
- в произ-ве С2Н4Вr2), Б. и бромную
воду применяют в аналит. химии, напр. для кулонометрич. определения As3+,
Sb3+, V4+, а также для качеств. и количеств, анализа
орг. соединений.
Мировое произ-во Б. (без СССР) ок. 300 тыс. т/год (1980). Главные производители:
США, СССР, Великобритания, Израиль, Франция, ГДР, ФРГ, Италия.
Б. ядовит. При работе с ним пользуются противогазом, перчатками и спецодеждой.
При содержании Б. в воздухе ок. 0,001% наблюдаются раздражение слизистых
оболочек, головокружение, кровотечение из носа, при 0,02% - удушье, спазмы
и заболевание дыхат. путей. ПДК 0,5 мг/м3. Попадание жидкого
Б. на кожу вызывает зуд, при длительном действии образуются медленно заживающие
язвы. При отравлении Б. пострадавшего нужно вывести на свежий воздух, дать
теплое молоко с содой. Кожа, обожженная Б., промывается многократно водой
и р-ром Na2CO3, смазывается мазью, содержащей NaHCO3.
Б. открыт в 1826 Ж. Баларом.
===
Исп. литература для статьи «БРОМ»: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1,
Л., 1974, с. 206-36; Ксензенко В. И., Стасиневич Д. С, Химия и технология
брома, иода и их соединений, М., 1979: Егоров Л. Ф., Осыка В. Г., Пивоваров
М. Д., Технология получения бромжелеза из природных рассолов, М., 1979;
Полянский Н. Г., Аналитическая химия брома, М., 1980; Bromine and its compounds,
ed. by Z.E. Jolles, L., 1966; Comprehensive inorganic chemistry, v. 2,
Oxf., 1973. В. И. Ксензенко, Ц. С. Стасиневич.
Страница «БРОМ» подготовлена по материалам химической энциклопедии.
|

