ЭЛЕКТРОСИНТЕЗ (электрохимический синтез), способ получения хим. соед. в процессе электролиза. В качестве анодов обычно используют оксиды Pb(IV), Ni, Mn(IV) и др. металлов, благородные металлы (Pt, Ir, Ru), графит и его модификации (стеклоуглерод, пирографит). Катодами чаще всего служат Pb, Hg, Cu, Zn, Ni, Fe или др. металлы. Исходное в-во -растворяют в полярном р-рителе (вода, низшие алифатич. спирты, ацетонитрил, ДМФА, диоксан). Наиб. эффективны процессы Э., если молекулы исходного в-ва диссоциируют в р-ре на ионы, а также если исходное в-во - орг. соед., в молекулах к-рого имеются полярные функц. группы. Если исходное в-во не является электролитом, необходимо добавление в-ва, придающего системе электропроводящие св-ва, но не участвующего в электродном процессе (фоновый электролит). Если исходное в-во не растворяется в используемом полярном р-рителе (напр., в воде), вводят дополнит. сорастворитель- в-во, растворимое в воде и растворяющее исходное в-во. Этот прием часто используют при Э. орг. в-в. Осн. характеристики пром. Э. следующие: 1) токовая нагрузка на электролизер. Для биполярных электролизеров различают линейную нагрузку Iл - ток в А, к-рый подводится к электролизеру, и эквивалентную нагрузку Iл-n, где n - число электродов. Эквивалентная нагрузка определяет производительность электролизера. макс. токовая нагрузка в пром. электролизерах редко превышает 50 кА. 2) Напряжение -разность электрич. потенциалов, прикладываемая к клеммам электролизера. Общее напряжение при Э. складывается из падения напряжения в электродах и токоподводящих шинах; теоретич. напряжения разложения для данной электрохим. системы, равного алгебраич. разности равновесных потенциалов анода и катода, рассчитываемых по Нернста уравнению; перенапряжения (см. Поляризация); падения напряжения из-за внутр. сопротивления электролита (гл. обр. в слое между электродами) и падения напряжения на диафрагме, разделяющей катодное и анодное пространства. 3) Плотность тока. Электродная плотность тока выражается отношением тока к площади пов-сти контакта электрода с электролитом, на к-рой происходит электродный процесс (измеряется в А/м2). Пром. Э. ведется при плотностях тока от 500 до 3000 А/см2. Объемная плотность тока измеряется в А на 1 л р-ра электролита и характеризуется совершенством конструкции электролизера. 4) Выход по току (в %) характеризует долю тока, к-рая расходуетея на получение целевого продукта.
5) Коэф. полезного использования электроэнергии - отношение теоретически необходимого кол-ва электроэнергии для получения единицы массы в-ва к практически затраченному, Теоретически необходимое кол-во электроэнергии W0 равно энергии, к-рую нужно затратить при протекании Э. со 100 %-ным выходом по току при напряжении, равном напряжению разложения. Драктически расход электроэнергии постоянного тока Wn определяется ф-лой:
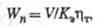
где V - напряжение в В, КЭ - электрохим. эквивалент в г/(А х час),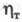 - выход по току (в %). Коэф. полезного использования электроэнергии - выход по току (в %). Коэф. полезного использования электроэнергии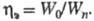
Электросинтез неорганических веществ. Пром. получение неорг. окислителей основано гл. обр. на анодном процессе (электроокислении), катодные процессы находят ограниченное применение. Анодные процессы проводят, как правило, в бездиафрагменных электролизерах, используя в качестве катодов сталь. Для подавления нежелат. процессов восстановления в р-р добавляют дихромат натрия; образующаяся на катоде хромит-хроматная пленка предотвращает восстановит, процессы.
В пром-сти применяют Э. для получения надсерной (пероксодисерной) к-ты H2S2O8 и ее солей - персульфатов; способ основан на электроокислении серной к-ты и сульфатов. Надсерная к-та и нек-рые ее соли используются в произ-ве пероксида водорода. Перманганат калия КМnО4 получают электроокислением манганата К2МnО4 или анодным растворением сплава Мn с Fe - ферромарганца. Диоксид марганца МnО2 в значит. масштабах производится электролизом сернокислых р-ров сульфата марганца MnSO4. Путем электроокисления синтезируют кислородсодержащие соед. хлора в разл. степенях окисления и др. продукты. Техн. характеристики наиб. важных процессов неорг. Э. представлены в табл. 1.
Табл. 1.- ХАРАКТЕРИСТИКИ ПРОМЫШЛЕННОГО ЭЛЕКТРОСИНТЕЗА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
|
Продукт |
Исходное в-во (его содержание в р-ре, г/л) |
Электроды |
Условия электролиза |
Выход по току, % |
Расход энергии, кВт х ч/кг |
|
|
анод |
катод |
|
напряжение, В |
т-ра, оС |
|
|
Гипохлорит натрия NaClO |
NaCl (50-100), Na2Cr2O7 (4-10) |
ОРТА* |
Нержавеющая сталь |
2,0 |
1,6 |
15-25 |
До 98 |
— |
|
|
Хлорат натрия NaC1O3 |
NaCl (280), Na2Cr2O7 (3-6) |
РbO2 |
Сталь-3** |
До 3,5 |
— |
70-80 |
94-96 |
6,0-7,3 |
|
|
Перхлорат натрия NaClO4 |
NaClO3 (700), Na2Cr2O7 (5) |
РbO2 |
Нержавеющая сталь |
2,5 |
2,1 |
35-60 |
85-97 |
3,3-4,2 |
|
|
Хлорная к-та НСlO4 |
HC1 (3-5), HC1O4 (40) |
Pt |
Нержавеющая сталь |
2,5 |
8,0 |
-20 |
80-85 |
4,7 |
|
|
Пероксодисерная к-та Н2S2О8 |
H2SO4 (500-600) |
Pt |
Нержавеющая сталь |
5-10 |
3,0-3,3 |
15-17 |
70-75 |
3,7-4,2 |
|
|
Пероксоборат NaH2BO4 |
Бура (40), Na2CO3 (130), NaHCO3 (15-20) |
Pt |
Ni |
5-6 |
4-6 |
10-12 |
55-60 |
|
|
|
Перманганат калия КМnO4 |
K2MnO4 (140), KMnO4 (90), К2CО3 (40) |
Ni |
Нержавеющая сталь |
0,9 |
2,6-3,0 |
50-60 |
83 |
~ |
|
|
То же |
КОН (250) |
Mn(Fe) |
Нержавеющая сталь |
1,5-4,5 |
— |
15-30 |
50 |
— |
|
|
Диоксид марганца МnO2 |
MnSO4 (350), H2SO4 (200) |
Pb |
Pb |
750 |
2,5-3,0 |
20-25 |
90-94 |
— |
|
* Оксидный рутениево-титановый анод. ** Содержит 0,3% углерода.
Табл. 2.- ХАРАКТЕРИСТИКИ ПРОМЫШЛЕННОГО ЭЛЕКТРОСИНТЕЗА ОРГАНИЧЕСКИХ ВЕЩЕСТВ
|
Продукт |
Исходное в-во |
Состав электролита (концентрация, г/л) |
Электроды |
Условия электролиза |
Выход по току, % |
Тип электролизера; материал диафрагмы |
|
|
анод |
катод |
|
напряжение, В |
т-ра, °С |
|
|
Адиподинитрил |
Акрилонитрил |
Соль Макки* (350) |
Pb/Ag |
Pb |
2,5-10,0 |
8-15 |
20-30 |
90-93 |
Фильтр-прессный; сульфированный полистирол |
|
|
То же |
Акрилонитрил |
K2HPO4 (100), [(С2Н5)4N]3РO4 (5) |
Fe3O4 |
Графит |
0,6 |
3-4 |
8-10 |
85-90 |
Ящичный; без диафрагмы |
|
|
Тетраэтилсвинец |
Этилмагнийхлорид |
С2Н5С1 (50), (C4H9OCH2CH2)2O (400) |
Pb |
Сталь-3 |
0,3 |
15-30 |
30-40 |
100 |
Кожухотрубный; полиэтилен |
|
|
Себациновая к-та |
Монометил адипинат |
СН3O2С(СН2)4СO2Н(340), CH3O2C(CH2)4C02Na (30), СН3ОН (62) |
Ti/Pt |
Сталь-3 |
4,0-6,0 |
12-18 |
60 |
75 |
Кожухотрубный; без диафрагмы |
|
|
Салициловый альдегид |
Салициловая к-та |
Na2SO4 (120), Н3РO4 (120), NaHSO3 (3) |
Pb/Ag |
Cu/Ag |
1,5 |
13-15 |
15 |
45-55 |
Ящичный; пористая резина |
|
|
Диацетокетогулоновая к-та |
Диацетонсорбоза |
NaOH (30) |
Ni |
Нержавеющая сталь |
1,0 |
3-6 |
55-70 |
94 |
Фильтр-прессный; без диафрагмы |
|
|
Глюконат кальция |
Глюкоза |
СаСО3 (50), NaBr (20) |
Графит |
Ni |
0,5 |
5-8 |
35 |
80-90 |
Ящичный; без диафрагмы |
|
|
п-Амннофенол |
Нитробензол |
H2SO4 (300) |
Pb/Ag |
Монель-металл |
2,0 |
3,8-4,6 |
25 |
73 |
Ящичный; керамика |
|
|
Трифторуксусная к-та |
Ацетил фторид |
KF (50), HF (940) |
Ni |
Fe |
4-6 |
0,6-0,3 |
5-15 |
85 |
Ящичный; без диафрагмы |
|
* Метилтриэтиламмониевая соль n-толуолсульфокислоты.
Электросинтез органических веществ. В орг. Э. различают процессы прямые и непрямые. В прямых процессах протекает обмен электронами между орг. в-вом и электродом с образованием промежут. ион-радикалов или своб. радикалов, к-рые вступают в разл. хим. процессы. На катоде орг. в-во присоединяет электроны, образуя анионы. Если в-во содержит кратную связь, последняя разрывается с образованием анион-радикалов. Эти частицы способны взаимод. с протонами, образуя продукты гидрирования, а также димеризоваться и реагировать с нуклеоф. реагентами. Практически те же типы р-ций протекают и на аноде, только первичным процессом является отдача электронов, приводящая к возникновению катионов и катион-радикалов, к-рые взаимод. друг с другом (димеризация), с р-рителем (анодное замещение) или с присутствующими в р-ре электрохимически неактивными в-вами (р-ции сочетания).
Молекулы орг. соед. во мн. случаях не обладают достаточной реакц. способностью и не вступают в р-ции на электродах. Э. с участием таких в-в проводят т. наз. непрямым электровосстановлением или электроокислением, осуществляемыми в объеме р-ра в присутствии катализаторов-переносчиков (медиаторов) - солей переходных металлов, кислородсодержащих анионов. Роль электролиза в данном случае сводится к регенерации на электродах хим. восстановителя или окислителя, к-рые превращают исходное в-во в целевой продукт.
Осн. процессы орг. Э. и их техн. характеристики представлены в табл. 2. Орг. Э. наиб. целесообразен для организации малотоннажных произ-в (фармацевтич. препаратов, душистых в-в, химикатов для фотографии и др.).
Лит.: Фиошин М. Я., Смирнова М. Г., Электросинтез окислителей и восстановителей, 2 изд., Л., 1981; Справочник по электрохимии, под ред. А.М. Сухотина, Л., 1981, с. 347-404; ТомиловА. П., Смирнов В. А., Каган Е. Ш., Электрохимические синтезы органических препаратов, Ростов-на-Дону, 1981; Якименко Л.М., Серышев Г.А., Электрохимический синтез неорганических соединений, М., 1984; Прикладная электрохимия, под ред. А. П. Томилова, 3 изд., М., 1984; Органическая электрохимия, пер. с англ., кн. 1-2, М., 1988.
А. П. Томилов. |

