|
ФОСФИТЫ ОРГАНИЧЕСКИЕ,
эфиры фосфористой к-ты общей ф-лы (RO)nP(OH)3_n,
где R - орг. радикал; n = 1-3. Различают полные (средние, или третичные
Ф. о., n = 3) и кислые (вторичные, n = 2; первичные, n=1)
Ф. о. Назв. Ф. о. включает назв. орг. радикала (радикалов) в алкоксильной группе,
к-рое является префиксом к слову "фосфит"; иногда Ф. о. наз. как
эфиры фосфористой к-ты [напр., C2H5OP(OC6H4NO2)OH
- этил(n-нитрофенил)фосфит, или этиловый
n-нитрофениловый эфир фосфористой к-ты]. Ф. о. наз. также соли кислых
эфиров фосфористой к-ты.
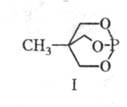
Полные Ф.о. Большинство
полных Ф. о.- подвижные бесцв. жидкости, нек-рые соед. (напр., содержащие группу
ArO, высшие или замещенные алкильные группы) - кристал-лич. в-ва (табл.). Соед.
обладают неприятным запахом, раств. в орг. р-рителях (со мн. карбонильными соед.,
галогенуглеводородами полные Ф.о. реагируют), практически не раств. в воде.
Конфигурация молекул триго-нально-пирамидальная. Величины m колеб
лются в пределах (5-6,67)·10-30 Кл·м; более высокие значения у циклич.
Ф. о. (напр., у соед. I - 1,39·10-29 Кл·м).
СВОЙСТВА НЕКОТОРЫХ ФОСФИТОВ
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хим. сдвиг, в спектре
ЯМР 31Р,
м. д.
|
Константа спин-
спинового взаимод. атомов P-H, Гц,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11( 1)
1)
|
|
|
|
|
|
|
|
|
|
680( 10) 10)
|
|
|
|
|
|
|
|
6( 2) 2)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
128(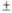 1)
1)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а Медленно
разлагается при нормальных условиях. б Разлагается при нагр.
в Т.пл. 30 0C. г 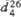 .
д Т.пл. 21-25 0C. е Т.пл. 97,8
0C. .
д Т.пл. 21-25 0C. е Т.пл. 97,8
0C.
В спектре ЯМР хим. сдвиги
31P находятся в области 90-150 м. д. (наименьшие значения у бициклофосфитов,
наиб. высокие - у моноциклич. соед.); константа спин-спинового взаимод. атомов
P и H в фрагменте Р —О —С —H 5-10 Гц.
В отсутствие кислых примесей
полные Ф. о. довольно устойчивы к нагреванию (до 200-300 0C) и гидролизу.
В результате термич. разложения образуются преим. кислые Ф. Полные Ф. о. в кислых
средах легко гидролизуются до кислых Ф. о., образуют комплексы с боранами, солями
и гидридами металлов; способны отщеплять атом О или S от мн. соед. (напр., N2O4,
H2O2, RNCO, RSH) с образованием фосфатов.
При взаимод. полных Ф.
о. с азидами и нек-рыми хлорами-нами образуются фосфазосоединения, при
действии ROOR, алкадиенов, нек-рых альдегидов и кетонов [напр., (CF3)2CO]
- фосфораны. Полные Ф. о. перегруппировываются в фосфонаты при действии
RHal и др. алкилирующих агентов (см. Арбузова реакция), а также 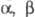 -непредельных
альдегидов и к-т. В р-ции с a-галогенкарбонильными соед. образуются преим. винил
фосфаты (см. Перкова реакция). -непредельных
альдегидов и к-т. В р-ции с a-галогенкарбонильными соед. образуются преим. винил
фосфаты (см. Перкова реакция).
Замещение группы RO на
др. орг. радикал происходит при действии RMgHal или ArLi, замещение на атомы
Hal - при действии XHal3 (X = P, В; Hal = Cl, Br, F) и RC(O)F. Триарил-фосфиты
в мягких условиях присоединяют Cl2 или Br2 с образованием
фосфоранов (ArO)3PHal2, тогда как (AlkO)3P
перегруппировываются в диалкилхлорфосфаты.
Триалкилфосфиты обычно
получают взаимод. PCl3 с RONa или со спиртами в присут. третичных
аминов либо NH3; р-цию фенолов с PCl3 можно вести без
акцептора HCl при 160-180 0C. Переэтерификацией (ArO)3P
или алкоголизом амидов (R2N)3P длинноцепочечными или функционально
замещенными спиртами получают Ф.о. с относительно большой мол. м. В нек-рых
случаях такими методами удается последовательно вводить разл. группы RO. 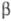 -Хлоралкилфосфиты
получают действием эпоксидов на соед. типа ClnP(OR)3_n
(n = 1-3).
Полные Ф. о. образуются также при восстановлении тионфосфатов (напр., с помощью
Na) и действии диазо-алканов надиорганилфосфиты. Винилфосфиты образуются в r-циях
PCl3 и хлорфосфитов с a-меркурированными кетона-ми и альдегидами,
а также с ацетоуксусным эфиром и его производными. -Хлоралкилфосфиты
получают действием эпоксидов на соед. типа ClnP(OR)3_n
(n = 1-3).
Полные Ф. о. образуются также при восстановлении тионфосфатов (напр., с помощью
Na) и действии диазо-алканов надиорганилфосфиты. Винилфосфиты образуются в r-циях
PCl3 и хлорфосфитов с a-меркурированными кетона-ми и альдегидами,
а также с ацетоуксусным эфиром и его производными.
Кислые Ф. о. Вторичные
Ф. о. с незамещенными алифатич. и смешанными алифатич. и ароматич. радикалами
- подвижные, перегоняющиеся при пониженном давлении жидкости; первичные Ф. о.
и диарилфосфиты - масла или кристаллич. соединения. Кислые Ф. о. раств. в орг.
р-рителях, низшие -в воде.
Кислые Ф. о. существуют
в виде таутомеров:
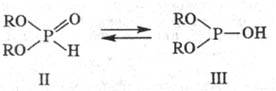
В обычных условиях структура
II преобладает (только эта структура фиксируется в спектре ЯМР 31P),
что обусловливает слабые кислотные св-ва этих в-в. Кислые Ф. о. более поляр-ны,
чем средние, напр. для (CH3O)2P(O)H и (CH3O)3P
m соотв. 9,81 · 10-30 и 6,04 · 10-30 Кл·м, для (C4H9O)2P(O)H
и (C4H9O)3P соотв. 106·10-29 и 6,4·10-30
Кл·м. В спектре ЯМР хим. сдвиги 31P находятся в пределах от
-1 до +24 м.д. В ИК спектре для (RO)2P(O)H полосы поглощения связей
P-H 2400-2450, P = O 1250-1295 см -1.
Вторичные Ф. о. в кислых
или щелочных средах легко гидролизуются до первичных Ф. о. В избытке к-ты и
H2O гидролиз может идти до H3PO3, напр.:
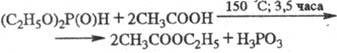
При длит. нагревании при
170-200 0C диалкилфосфиты частично изомеризуются в пирофосфонаты
AlkP(O)(OH)OPAlk(O)OH [первичные Ф.о. дают первоначально смесь (AlkO)2P(O)H
и H3PO3].
Вторичные Ф. о. образуют
соли (их также наз. фосфитами) при взаимод. с щелочными и щел.-зем. металлами
(а также с их гидридами) либо с оксидами и солями.
В смеси вторичных Ф. о.
с ROM (M = Na, К) устанавливается равновесие:

В молекулах солей (RO)2POM
(M = Li, Na, К) атом P трехкоординационный, для солей Hg, по-видимому, присуща
структура с атомом четырехкоординационного P (RO)2P(O)HgX (X = Hal).
Кислые Ф. о. вступают в
многочисленные р-ции с участием группы P-H, напр.:
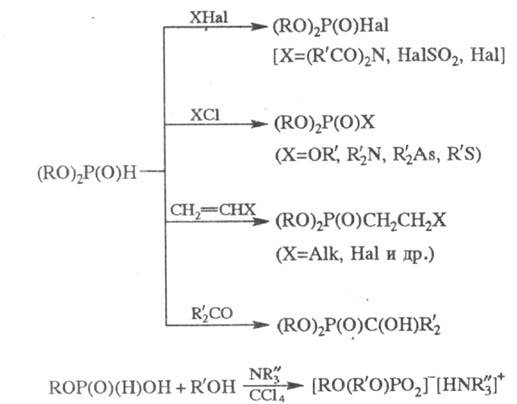
При действии O3,
SO3, N2O4, S8 кислые Ф. о. окисляются
до соответствующих фосфатов; при нагр. со спиртами они переэтерифицируются.
Обычно диалкилфосфиты получают
по р-ции:
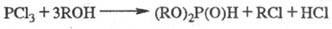
В пром-сти этот процесс
часто осуществляют как непрерывный, подавая емесь реагентов в р-рителе при низкой
т-ре под давлением в реактор, из к-рого отводят HCl и пары р-рителя, а жидкие
продукты подают на колонну для фракционирования.
Диалкил- и диарилфосфиты
получают также гидролизом соед. типа (RO)2PX (X = OR, R2N,
Hal); деалкилированием (RO)2POAlk с помощью к-т; действием спиртов
на H3PO3 или P4O6; действием алкилирующих
агентов на фосфиды металлов; переэтерификацией (RO)2P(O)H.
Моноарилфосфиты обычно
получают нагреванием (ArO)3P с H3PO3 (2 эквивалента),
а моноалкилфосфиты - этерифика-цией H3PO3 или гидролизом
эфиров типа ROPX2 (X = OR', NR2, Cl).
Ф. о.- добавки для модификации
пластмасс и текстильных материалов [напр., X(CH2)nOP(OR)2,
(X = Cl, Br, ОН, n = 2-10) - антистатики, стабилизаторы, пламегасители,
пластификаторы], антиоксиданты и стабилизаторы полимерных пленок в пищ. пром-сти
[(C9H19O)nPOH (n= 1, 2)], добавки
к маслам и гидравлич. жидкостям [(C4H9O)2P(O)H,
(PhO)3P, (ArO)2P(O)H и др.], стабилизаторы эмульсий в
фотографии [напр., (ArO)3P], инициаторы полимеризации олефинов [напр.,
(PhO)3P], бактерицидные ср-ва [комплексы (AlkO)3P·CuCN],
адгезивы, ПАВ [(RO)2P(O)H, R содержит 5-16 атомов С]. Ф. о. используют
также в синтезе фосфорсодержащих полимеров, пестицидов, лек. ср-в и др.
См. также Диметилфосфит,
Триметилфосфит, Трифенил-фосфит, Три-b-хлорэтилфосфит, Фосфористой кислоты
амиды.
===
Исп. литература для статьи «ФОСФИТЫ ОРГАНИЧЕСКИЕ»: Общая органическая
химия, пер. с англ., т. 4, M.. 1983, с. 670-718; Нифaнтьев Э.Е., Химия фосфорорганических
соединений, M., 1971, с. 13-103; Gerrard W., Hundson H., в кн.: Organic phosphorus
compounds, eds. G. Kosolapoff, L. Maier, N. Y., v. 5, 1973, p. 21-329;
Doak G., Freed-man L., "Chem. Rev.", 1961, v. 61, № 1, p. 31
-44. Г. И. Дрозд.
Страница «ФОСФИТЫ ОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
|

