|
ТЕМПЕРАТУРА (от
лат. temperatura- надлежащее смешение, нормальное состояние), термодинамич.
параметр, характеризующий состояние термич. равновесия макроскопич. системы.
Наряду с давлением, хим. потенциалом и др. параметрами состояния, температура
относится к интенсивным величинам, т.к. не зависит от массы системы. Согласно
принципу термич. равновесия, две фазы А и В, адиабатически изолированные от
окружающей среды (внутр. энергии фаз соотв. ЕА + ЕВ
= const), могут находиться в состоянии равновесия, к-рое характеризуется
определенными значениями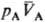 и и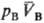 (рА,
рB-давления; (рА,
рB-давления;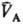 , ,
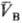 -молярные объемы фаз). Экспериментально установлено, что если фаза А находится
в равновесии с фазой В, а В-с С, то А и С также находятся в равновесии. Из принципа
термич. равновесия следует, что каждая фаза обладает эмпирической температурой q-измеримым
св-вом такого рода, что из qА(рA;
-молярные объемы фаз). Экспериментально установлено, что если фаза А находится
в равновесии с фазой В, а В-с С, то А и С также находятся в равновесии. Из принципа
термич. равновесия следует, что каждая фаза обладает эмпирической температурой q-измеримым
св-вом такого рода, что из qА(рA;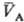 )
= qB(рB; )
= qB(рB;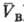 )
и qB(рB; )
и qB(рB;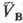 )
= qC(рC; )
= qC(рC;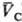 )
следует qА(pА; )
следует qА(pА;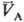 )
= qс(рс; )
= qс(рс;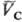 ). ).
Если две фазы с разл. q
приведены в тепловой контакт друг с другом через пов-сть раздела и qА
> qВ, возникает поток теплоты от А к В, т. е. от более
нагретой фазы к менее нагретой. При qА = qВ
тепловой поток отсутствует. Принцип термич. равновесия впервые сформулирован
Дж. Блэком в кон. 18 в. В термодинамику он введен, однако, позднее первого и
второго начал термодинамики, поэтому его часто называют нулевым началом термодинамики.
Существует множество ф-ций
q(p,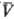 ),
удовлетворяющих нулевому началу. Конкретный вид q(p, ),
удовлетворяющих нулевому началу. Конкретный вид q(p,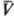 )
определяется используемым измерит. прибором-термометром и способом построения
термометрич. шкалы. )
определяется используемым измерит. прибором-термометром и способом построения
термометрич. шкалы.
Понятие абсолютной Т. введено
У. Томсоном (лордом Кельвином) в 1848 на основании теоремы Карно, согласно к-рой
все обратимые тепловые машины, где рабочее тело совершает круговой процесс между
нагревателем с эмпирической температурой q1 и холодильником с эмпирической
Т. q2, имеют одинаковый кпд h, независимо от природы рабочего
тела:
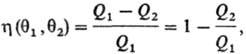
где Q1-
тепло, отбираемое рабочим телом от нагревателя, Q2-тепло,
передаваемое холодильнику. Значения q1 и q2 можно
измерить с помощью произвольной шкалы Т., величины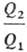 и
h при смене шкалы остаются постоянными. Абсолютная Т. вводится соотношением: и
h при смене шкалы остаются постоянными. Абсолютная Т. вводится соотношением:

где T1
и Т2-абсолютные Т. нагревателя и холодильника соотв., причем
T1 есть ф-ция только q1, а Г2-только
q2. Для построения шкалы абсолютной температурой достаточно приписать
определенное значение Т, одному известному термич. состоянию. В настоящее время
по международному соглашению принято, что абсолютная (термодинамич.) Т. плавления
воды при нормальном давлении равна 273,15 К (точно). Абсолютный нуль Т. (или
нулевая абсолютная Т.) имеют ясный физ. смысл как Т. холодильника в цикле Карно,
при к-рой кпд тепловой машины h = 1. Тело, находящееся при нулевой температурой,
не способно передавать теплоту к.-л. другому телу. Единица измерения абсолютной
Т. в системе СИ-градус Кельвина (Кельвин, К). Конкретные измерения абсолютной
Т. осуществляются с помощью набора спец. термометров (подробнее см. Термометры,
Термометрия).
Согласно строгой формулировке
второго начала термодинамики (аксиоматика Каратеодори), абсолютная Т. вводится
как интегрирующий делитель для бесконечно малого
кол-ва теплоты dQ, полученного системой, обладающей внутренней
энергией Е, в обратимом процессе. Величина dQ/T
является полным дифференциалом ф-ции состояния S, наз. энтропией. Абсолютная
Т. выражается соотношением:
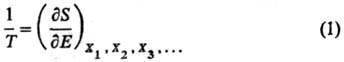
X1, X2,
Х3, ...-экстенсивные термодинамич. переменные (объем V,
электростатич. индукция D, магн. индукция В и т.п.). Абсолютная
Т. и эмпирическая температура q связаны аналит. зависимостью для систем, у к-рых
E является ф-цией только Ти V:
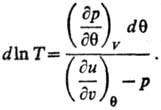
Аналит. связь p,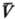 и
Т для фазы наз. уравнением состояния. В статистической термодинамике
аналогом ур-ния (1) служит соотношение: и
Т для фазы наз. уравнением состояния. В статистической термодинамике
аналогом ур-ния (1) служит соотношение:
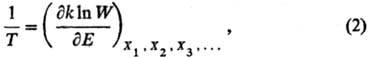
где W— термодинамич.
вероятность, k-постоянная Больц-мана. Термодинамич. вероятность W(E)равна числу возможных состояний системы, при к-рых последняя обладает внутр.
энергией Е. Термодинамич. вероятность связана с энтропией соотношением
Больцмана S = kln W. Для обычной макроскопич. системы величина
W- быстро возрастающая ф-ция Е и, следовательно, абсолютная Т.
положительна.
Термич. равновесие двух
систем А и В (EА + ЕB = const), определяемое
равенством т-р TА = ТB, соответствует наиб.
вероятному распределению энергии между А и В. Если В представляет собой обширный
тепловой резервуар (ЕВ >> EА),
то абсолютная Т. определяет плотность вероятности Р(Е) для
системы А находиться в состоянии с заданной энергией EA,r
при термич. равновесии с системой В:
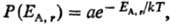
где, суммирование ведется
по всем значениям
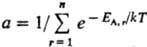 энергии EA.r
(r = 1,2,... , п) подсистемы А (канонич. распределение
Гиббса). Частными случаями канонич. распределения являются распределения молекул
идеального газа по энергиям и скоростям (распределения Больцмана и Максвелла). энергии EA.r
(r = 1,2,... , п) подсистемы А (канонич. распределение
Гиббса). Частными случаями канонич. распределения являются распределения молекул
идеального газа по энергиям и скоростям (распределения Больцмана и Максвелла).
Важные физ. постоянные
в-ва-его Т. кипения, плавления, фазовых переходов, полиморфных превращений,
а также критическая температура (см. Критическое состояние), тройные точки.
Практически все физ.-хим.
величины зависят от температуры. Важными примерами являются температурные зависимости:
1) константы скорости хим.
р-ции к:
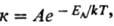
где EA-энергия
активации, A-предэкспоненциальный множитель (см. Аррениуса уравнение,
Константа скорости, Энергия активации).
2) Константы равновесия
хим. р-ции Кр:
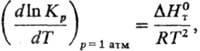
где R-газовая постоянная,
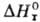 -стандартная
энтальпия р-ции. -стандартная
энтальпия р-ции.
3) Теплового эффекта хим.
р-ции при постоянном давлении (DH) и постоянном объеме (DU):
(9DН/9Т)р
= DСр, (9DU/9Т)V
= DСV,
где H и U-энтальпия
и внутр. энергия системы, Ср и СV-теплоемкости
при постоянном давлении и постоянном объеме соотв. (см. Кирхгофа уравнение).
4) Теплоты равновесного
фазового перехода L:
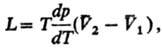
где 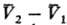 -изменение
молярного объема при переходе в-ва
из фазы 1 в фазу 2 (см. Клапейрона -Клаузиуса уравнение). -изменение
молярного объема при переходе в-ва
из фазы 1 в фазу 2 (см. Клапейрона -Клаузиуса уравнение).
5) Стандартной электродвижущей
силы E0 гальванич. цепи:
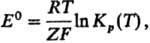
где Кр(Т)-константа
равновесия электродного процесса, F-Фарадея постоянная, Z-число
переносимых электронов (см. Электрохимические цепи).
6) Объемной плотности rv
излучения абсолютно черного тела с частотой v (ф-ла Планка):
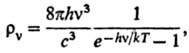
где с-скорость света,
h-постоянная Планка.
Полной объемной плотности
излучения по всем частотам (закон
Стефана - Больцмана):
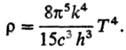
7) Степени ионизации a
газа, состоящего из атомов А:
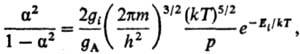
где Ei-энергия
ионизации атома, m-масса электрона; gi, gА-статистич.
веса ионов и атомов (ур-ние Саха).
Понятие Т., сформулированное
для равновесного состояния системы в целом, используется и для характеристики
локального термодинамич. равновесия, если система в целом неравновесна и ее
Т. рассматривается как непрерывная ф-ция координат и времени. При локальном
термодинамич. равновесии малые элементы объема приближенно рассматриваются как
равновесные, обладающие каждый своей температурой, и учитывается обмен энергией (энтропией)
между ними. Локальное термодинамич. равновесие-одно из осн. понятий термодинамики
необратимых процессов. В ряде физ. задач неравновесная система м. б. разбита
на подсистемы, в к-рых время установления термич. равновесия много меньше времени
достижения равновесия системой в целом. Подобная ситуация м. б. охарактеризована
тем, что каждой из подсистем соотносится своя Т., отличная от температуры других подсистем.
Напр., в полупроводниках температура электронов проводимости в сильном электрич. поле
много выше Т. решетки; в плазме отдельно рассматривают Т. электронов и Т. ионов.
В нач. 50-х гг. 20 в. сформулировано
понятие отрицательных абсолютных Т. Такие Т. могут возникать в системах, если
с ростом энергии Е термодинамич. вероятность W (или энтропия S)не возрастает, а убывает, в результате
чего производная 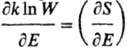 становится меньше
нуля (см. ф-лы 1 и 2). Подобная ситуация реализуется для таких систем, в к-рых
энергия Е ограничена снизу и сверху. Так, двухуровневая система, состоящая
из N ядерных спинов во внеш. магн. поле (напр., ионы Li+ в
кристалле LiF), имеет миним. энергию NE1, максимальную
NE2, где E1 и Е2-энергии
спина ядра на нижнем и верхнем уровнях. Начиная с энергии, равной N(E1
+ E2)/2, термодинамич. вероятность W убывает с ростом
энергии, что позволяет говорить об отрицательной Т. подсистемы (ионы Li+),
но не для системы в целом. Рассматриваемая подсистема
должна быть термически слабо связана с системой в целом, для к-рой отсутствуют
ограничения по энергии.
становится меньше
нуля (см. ф-лы 1 и 2). Подобная ситуация реализуется для таких систем, в к-рых
энергия Е ограничена снизу и сверху. Так, двухуровневая система, состоящая
из N ядерных спинов во внеш. магн. поле (напр., ионы Li+ в
кристалле LiF), имеет миним. энергию NE1, максимальную
NE2, где E1 и Е2-энергии
спина ядра на нижнем и верхнем уровнях. Начиная с энергии, равной N(E1
+ E2)/2, термодинамич. вероятность W убывает с ростом
энергии, что позволяет говорить об отрицательной Т. подсистемы (ионы Li+),
но не для системы в целом. Рассматриваемая подсистема
должна быть термически слабо связана с системой в целом, для к-рой отсутствуют
ограничения по энергии.
При физ.-хим. исследованиях
условно выделяют область низких Т. (см. Криохимия) и область высоких
Т. (обычно 500-3000 К), к-рую рассматривают как химию высоких Т., или просто
высокотемпературную химию. Т. в интервале 500-3000 К получают методами радиационного
и лазерного нагрева, электронной и ионной бомбардировки. Объекты высокотемпературной
химии, как правило,-неорг. соединения. Характерными чертами высокотемпературных
хим. процессов являются: 1) сравнительно малая роль констант скорости, энергий
активации и т. п. кинстич. факторов, поскольку скорость р-ций высока и в системе
быстро устанавливается равновесие; 2) увеличение роли газовой (паровой) фазы
из-за интенсивных процессов испарения; 3) необходимость учета влияния заряженных
частиц-ионов и электронов, возникающих в результате термодиссоциации (см. Ионы
в газах, Ионно-молекулярные реакции). Высокотемпературными процессами
являются мн. металлургич. произ-ва, процессы напыления пленок, монокристаллов
выращивания из газовой фазы и др.
Процессы в области Т. 3000-5000
К изучаются плазмо-химией.
===
Исп. литература для статьи «ТЕМПЕРАТУРА»: Кричевский
И. Р., Понятия и основы термодинамики, 3 изд., М., 1962; Рей Ф., Статистическая
термодинамика, пер. о англ., М., 1986.
М. В. Коробов.
Страница «ТЕМПЕРАТУРА» подготовлена по материалам химической энциклопедии.
|

