|
ОЗОН (от греч. ozon-пахнущий)
О3, аллотропная форма кислорода. Газ синего цвета, в жидком состоянии
темно-синий, в твердом-сине-фиолетовый. Молекула О3 симметричная
ангулярная (уголковая); длина связи О—О 0,12717 нм, угол ООО 116,78°, m
1,78· 10-30 Кл·м. Т. пл. 80,6 К, т. кип. 161,2 К; плотн. газа при
273,2 К 2,141 г/л, при 298,2 К 1,962 г/л; плотн. жидкого при 90,2 К 1,571 г/см3,
при 123,2 К 1,473 г/см3, при 153,2 К 1,376 г/см3; плотн.
кристаллов при 77,4 К 1,728 г/см3; при 90,2 К h 1,57·10-3
Па·с, g 3,84·10-2 Н/м; температурная зависимость давления пара над
жидкостью lg p(мм рт.ст.) = 8,25313 - 814,941587/Т-- 0,001966943Т;
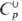 39,374
ДжДмоль•К); 39,374
ДжДмоль•К); 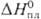 2,1 кДж/моль,
2,1 кДж/моль,
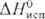 15,2 кДж/моль,
15,2 кДж/моль, 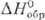 141,8 кДж/моль;
141,8 кДж/моль;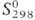 238,896 ДжДмоль•К). В газе О. диамагнитен, в жидком состоянии слабо парамагнитен,
магн. восприимчивость + 1,8·10-6. В УФ спектре О. имеет широкую сильную
полосу поглощения в интервале 200-300 нм с максимумом при l 255 нм (полоса Гартли).
238,896 ДжДмоль•К). В газе О. диамагнитен, в жидком состоянии слабо парамагнитен,
магн. восприимчивость + 1,8·10-6. В УФ спектре О. имеет широкую сильную
полосу поглощения в интервале 200-300 нм с максимумом при l 255 нм (полоса Гартли).
Р-римость О. в воде (0,21
объема в 1 объеме р-ра при 298 К) почти в 7 раз выше р-римости О2.
В кислой среде р-римость О. падает, в щелочной-возрастает. Гораздо выше р-римость
О. в хлорир. углеводородах и хладонах:
* Отношение мол. концентраций
О3 в р-ре и газе над р-ром.
Неограниченная взаимная
р-римость в жидкой системе О2-О3 имеет место выше 93,2
К, в системе F2-О3-выше 79,3 К, в системе СF4-О3-выше
103 К, ниже этих т-р р-ры расслаиваются.
О. термически неустойчив
в газе и в р-рах. В водном р-ре распад О. медленно идет при комнатной т-ре и
заметно ускоряется с ростом рН. В газе более устойчив; медленный распад идет
ок. 70 °С, быстрый-выше 100 °С. Распад О. ускоряют примеси NO, Cl2
и др. газов, а также гетерог. катализаторы - металлы и их оксиды (Pt, Ag, Cu,
Mn, Ni, Co и др.).
В р-циях с большинством
в-в О.—сильный окислитель, что обусловлено низкой энергией отрыва атома О от
молекулы О3 (107 кДж/моль) и высоким сродством молекулы О. к электрону
(2,26 эВ). В водном р-ре О. окисляет Fe(II) до Fe(III), Ce(III) до Ce(IV), Mn(II)
до MnO-4, соед. Os и Ru до OsO4
и RuO4,I2 до НIO3 и т. п. В газовой фазе О.
окисляет Сl2 до Сl2О7 (фотохимически), SO2
до SO3, NO2 до N2O5. Р-ция с конц.
водной щелочью идет через последоват. образование в р-ре O-3,
О-2, HO-2 и О2. При взаимод.
с кристаллич. гидроксидами и супероксидами щелочных металлов образуются озониды
МО3. О. окисляет мн. орг. в-ва-олефины, ароматич. соед. и насыщ.
углеводороды, спирты и др., при этом в качестве промежут. в-в образуются продукты
присоединения О., также наз. озонидами (см. Озонирование).
Общая масса О. в атмосфере
Земли 4·109 т, т.е. 0,64·10-6 от массы всей атмосферы,
средняя стационарная концентрация 1 мг/м3. У пов-сти Земли фоновая
концентрация О. в течение суток проходит через максимум в интервале 10-18 ч
и минимум ночью; летом и весной концентрация в 3,5 раза выше, чем зимой и осенью;
над полярными областями Земли концентрация выше, чем над экваториальной, в атмосфере
городов выше, чем в сельской местности. С удалением от пов-сти Земли концентрация
растет и достигает максимума на высоте 20-25 км. Концентрация О. на высоте 20-30
км каждые 11 лет проходит через максимум, вызванный циклом солнечной активности.
О. обеспечивает сохранение
жизни на Земле, т. к. озоновый слой задерживает наиб. губительную для живых
организмов и растений часть УФ радиации Солнца с длиной волны менее 300 нм,
наряду с СО2 поглощает ИК излучение Земли, препятствуя ее охлаждению.
Содержание и перемещение О. в атмосфере влияет на метеорологич. обстановку.
Образование О. в атмосфере происходит в результате р-ций: О2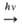 О
+ О, О + О2 О
+ О, О + О2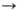 О3.
Распад атмосферного О. происходит фотохимически, а также в результате его р-ций
с радикалами НО и НО2, оксидами азота, хлором и его соединениями.
Массовый выброс в атмосферу оксидов азота в результате развития реактивной авиации
и применения удобрений, а также использование хлорсодержащих хла-донов (фреонов),
может привести к убыли О. в атмосфере. Мощные вулканич. извержения, сопровождаемые
выбросом аэрозоля в стратосферу, также приводят к понижению содержания О. в
средних широтах на 4-8%. По оценкам ядерная война с тротиловым эквивалентом
5000 Мт приведет к 50%-ному разрушению озонового слоя, на его восстановление
потребуется 5-8 лет. О3.
Распад атмосферного О. происходит фотохимически, а также в результате его р-ций
с радикалами НО и НО2, оксидами азота, хлором и его соединениями.
Массовый выброс в атмосферу оксидов азота в результате развития реактивной авиации
и применения удобрений, а также использование хлорсодержащих хла-донов (фреонов),
может привести к убыли О. в атмосфере. Мощные вулканич. извержения, сопровождаемые
выбросом аэрозоля в стратосферу, также приводят к понижению содержания О. в
средних широтах на 4-8%. По оценкам ядерная война с тротиловым эквивалентом
5000 Мт приведет к 50%-ному разрушению озонового слоя, на его восстановление
потребуется 5-8 лет.
О. образуется во всех процессах,
сопровождаемых появлением атомарного кислорода, -при УФ облучении воздуха, в
электроразрядах, при распаде пероксидов, окислении фосфора и т.п. В лабораториях
и пром-сти О. получают действием тихого электрич. разряда на О2 в
озонаторах. Осн. типы пром. озонаторов-трубчатые и плоские; в качестве диэлектрика
применяют стекло или керамику, материал электродов - Аl или Си. Мощность озонатора
пропорциональна частоте тока. Присутствие влаги в О2 сильно снижает
выход О., поэтому исходный газ осушают до точки росы (от -40 до -60 °С),
а озонатор охлаждают. Содержание О. на выходе из озонатора при использовании
в качестве исходного О2 5-8%, воздуха-1-1,5%, расход энергии соотв.
8-18 и 10-30 кВт·ч/кг О3. О. более высокой концентрации (до 50%)
м. б. получен электролизом конц. р-ров НСlО4, Н3РО4
или H2SO4 на охлаждаемом аноде из Pt или РbО2.
Др. способ получения высококонцентрированного О.-растворение его в хладонах
при низкой т-ре, О2 в хладонах практически не растворяется. Наиб.
удобны хладо-ны 22 и 12, р-римость О. в них при 163 К достигает 50%; при нагр.
такого р-ра О. испаряется первым. Р-ры О. в фреонах не взрывчаты и могут длительно
храниться при т-ре ниже 223 К.
Для определения содержания
О. используют фотометрич. (в УФ области), иодометрич., люминесцентный методы
и ряд способов, основанных на измерении физ. св-в О., -e, энтальпии разложения
и т.п.
О. ядовит для людей, животных
и растений; ПДК в воздухе рабочей зоны 0,1 мг/м3, в атм. воздухе
0,16 мг/м3; ЛД50
0,046 мг/л (мыши, 2 ч), 3 мг/л (мыши, 5 мин). Малые концентрации О. в воздухе
создают ощущение свежести, вдыхание воздуха с концентрацией О. 0,002-0,02 мг/л
вызывает раздражение дыхат. путей, кашель, рвоту, головокружение, усталость.
В присут. оксидов азота токсичность О. увеличивается в 20 раз.
О. взрывоопасен во всех
агрегатных состояниях, примеси повышают его чувствительность. Ниж. КПВ для озоновоз-душной
смеси 9%, при более высоком содержании О. смеси взрываются под влиянием внеш.
импульса, причем скорость детонации растет от 880 м/с при концентрации 9,2 мол.
% О. до 1730 м/с при 77 мол. %.
Осн. часть производимого
О. используют для обеззараживания питьевой воды, что более эффективно, чем хлорирование.
О. используют также для обезвреживания сточных вод хим. предприятий, особенно
в случае фенольных и цианидных загрязнений. О. применяют для получения камфоры,
ванилина, монокарбоновых и дикарбоновых к-т (ади-пиновой, азелаиновой и др.)
путем окисления углеводородов и др. малоценного сырья, для отбеливания тканей,
минер. масел и др., в орг. химии - для определения места двойной связи в молекуле.
О. открыл и назвал X. Шёнбейн
в 1840, на появление специфич. запаха при электроразряде в воздухе обратил внимание
М. ван Марум в 1785.
===
Исп. литература для статьи «ОЗОН»: Разумовский
С. Д., Заиков Г.Е., Озон и его реакции с органическими соединениями, М., 1974;
Атмосферный озон и изменения глобального климата, Л., 1982. В. Я. Росоловский.
Страница «ОЗОН» подготовлена по материалам химической энциклопедии.
|

