МАРГАНЕЦ (от нем. Manganerz - марганцевая руда; лат. Manganum) Mn, хим. элемент VII гр. периодич. системы, ат. н. 25, ат. м. 54,9380. В природе один устойчивый изотоп 55Мn. Конфигурация внеш. электронной оболочки атома 3d54s2, степени окисления от +2 до +7, наиб. устойчивы соед. Мn(II) и Mn(VII); энергии ионизации при последоват. переходе от Мn0 к Мn2+ соотв. равны 7,435 и 15,6401 эВ; элсктроотрицатсльность по Полингу 2,5; ионные радиусы (в скобках указаны координац. числа) Мn2+ 0,080 нм (4), 0,089 нм (5), 0,104 (7), Мn7+ 0,039 (4), 0,060 нм (6).
Содержание М. в земной коре 0,1% по массе, в океанич. воде 2.10-7%. В своб. виде в природе не встречается. Входит в состав множества минералов, преим. типа оксидов. наиб. распространены пиролюзит b-МnО2, псиломелан mМО.nМnО2.хН2О [М = Ва, Са, К, Мn(II)], манганит b-MnOOH, браунит 3Мn2О3.MnSiO3, родохрозит МnСО3. Главные месторождения марганцевых руд (50-75% мировых
запасов, 1981) находятся в СССР. За рубежом крупнейшие месторождения известны в ЮАР (более 3 млрд. т, в пересчете на металл), Австралии (490 млн. т), Габоне (450 млн. т), Бразилии (100 млн. т), Индии (80 млн. т), Гане (10 млн. т). Общая мировая добыча марганцевых руд 20-25 млн. т/год. Большое кол-во М. содержат железо-марганцевые конкреции, расположенные в Тихом, Атлантическом и Индийском океанах; их ресурсы в Тихом океане оцениваются в 90-1650 млрд. т.
Свойства. Компактный М. - серебристо-белый металл. Известно 4 кубич. кристаллич. модификации М.: ниже 710°С устойчива a-форма (а = 0,89125 нм, z = 58, пространств. группа I43m, плотн. 7,44 г/см3), при 710-1090°С - b-форма (а = 0,6300 нм, z = 20, пространств. группа P413, плотн. 7,29 г/см3), при 1090-1137°С - g-форма (а = 0,38550 нм при 1100°С, z = 4, пространств. группа Fm3m, плотн. 6,37 г/см3), выше 1137°С - d-форма (а = 0,30750 нм при 1143°С, z = 2, пространств. группа Im3m, плотн. 6,28 г/см3); DH0 полиморфных переходов (в кДж/моль) a : b 2,2, b : d 2,1, d : g 1,9. При охлаждении до комнатной т-ры g-форма переходит в тетрагон. кристаллич. модификацию (а = 0,3774 нм, с = 0,3525 нм, плотн. 7,21 г/см3). Т. пл. 1244°С, т. кип. ок. 2080 °С; С°р [в Дж/(моль.К)] a-формы 26,3, b 26,5, g 27,6; DH0пл 12,0 кДж/моль, DH0исп 227 кДж/моль; ур-ния температурной зависимости давления пара lgр (Пa)= 10,8828 —
13625/Т (1043 [ Т [ 1158 К) и lgp (Па) = 20,005 -
14850/T - 2,52 lgT(1517 [ T [ 2353 К); температурный коэф. линейного расширения (в К-1) в интервале 0-20oС для a-Мn 2,23 • 10-5, b 2,49 • 10-5, g 1,475 • 10-5; r (в мкОм.см) для a-Mn ~ 140, b 91, g 35-40; температурный коэф. r (в К-1) для a-Мn (2-3).10-4, b 1,36.10-3, g (5,5-6,5).10-3; теплопроводность 66,5 Вт/(см.К). Ниже — 173°С М. антифeрромагнитен, при более высоких т-рах парамагнитен; магн. восприимчивость +9,6.10-6. Модификации a, b и d хрупкие, g-Mn пластичен, но после деформации медленно разрушается; твердость по шкале Роквелла a-Мn 70, g-Мn 20.
М. легко окисляется на воздухе, образуя выше 800°С окалину, состоящую из внутр. слоя МnО и внеш. слоя Мn3О4. Ниже 800 °С образуется Мn2О3, а при т-рах ниже 450°С - МnО2 (см. Марганца оксиды). Поглощает Н2 (до 60 см3 на 100 г М.) с образованием твердых р-ров.
М. взаимод. с галогенами, давая дигалогениды МnХ2 (с фтором также MnF3 и MnF4) - кристаллы; хорошо раств. в воде (кроме MnF2); образуют кристаллогидраты (см. также табл.). Для MnBr2 т. пл. 698 °С, MnI2 638°С. Дихлорид MnCl2 получают взаимод. MnО2 с конц. соляной к-той или Mn, MnО либо MnСО3 с газообразным НCl; применяют для получения пигментов, как катализатор в орг. синтезе, реагент для обнаружения S2O82- , IO4-, для обработки семян с целью ускорения роста растений, в физ.-хим. анализе как репер.
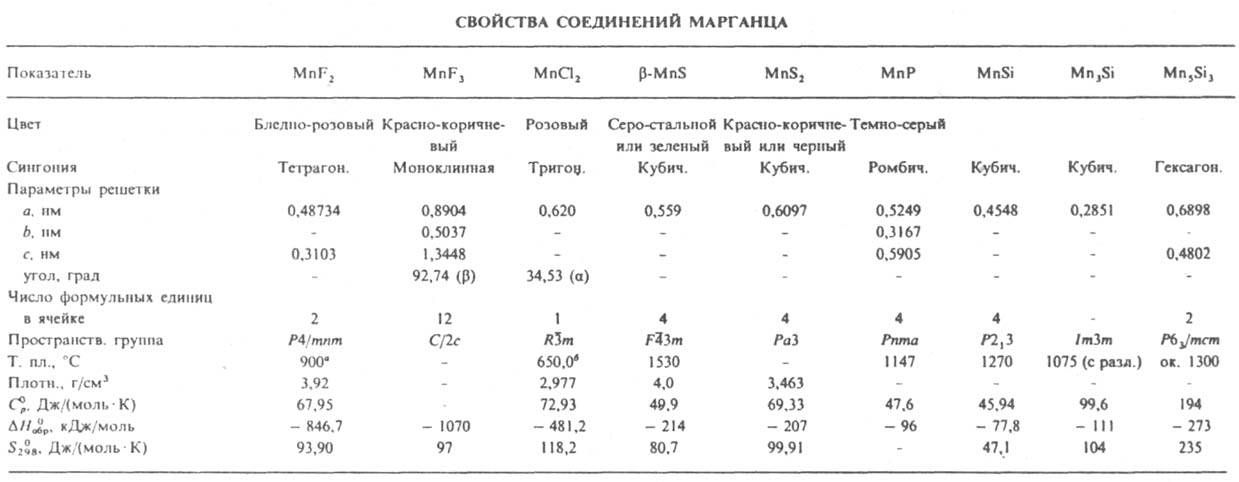
* Т. кип. ок. 1640°С; DH0пл 14 кДж/моль, DH0исп 256 кДж/моль. * Т. кип. 1240°С; DH0пл 37,6 кДж/моль, DH0исп 148 кДж/моль.
Трихлорид MnCl3 образуется при взаимод. MnО2 с р-ром НCl в этаноле при - 63 °С; при нагр. до 40 °С разлагается с выделением Cl2. Быстрым охлаждением паров, образующихся при взаимод. MnF3 с F2 при т-рах выше 550°С, получают тетрафторид MnF4 - голубые кристаллы; при нагр. до 70 °С разлагается с выделением F2; DH0обр -1109 кДж/молъ.
При нагр. М. взаимод. с S, N2, P, С, Si и др. неметаллами. Известны нитриды: MnN6, Mn5N2, Mn4N, MnN, Mn6N5, Mn3N2 и MnxN с х = 9,2-25,3. Сульфид MnS существует в трех кристаллич. модификациях (b-форма - минерал алабандин); плохо раств. в воде и м. б. осажден из р-ров солей Mn2+ сульфидами щелочных металлов.
Фосфиды М.: MnР, MnР3, Mn2Р (т. пл. 1327°С), Mn3Р (т. пл. 1105°C), Mn3P2 (разлагается при 1090 °С) и Mn4Р (т. пл. 1085°С с разл.).
Карбиды М.: Mn3С [разлагается при 950°С, С°р 93,3 Дж/(моль.К), DH0обр 5,6 кДж/моль, S0298 98,7 Дж/(моль.К)], Mn5С2 (разлагается при 1050 °С, DH0обр -66,1 кДж/моль), Mn15С4 (разлагается при 850 °С), Mn7С3 [разлагается при 1100°С, DH0обр -98,7 кДж/моль, S0298 217 Дж/(моль.К)], Mn23С6 (разлагается при 1025 °С, DH0обр -287 кДж/моль), Mn2С7. Макс. р-римость углерода в a-, b- и g-Mn соотв. равна 1,3, 0,4 и 2,0% по массе.
Силициды М.: MnSi, MnSi1,7 [т. пл. 1160°С с разл., C0p 58,70 Дж/(моль.К), DH0обр -83,7 кДж/моль, S0298 55,5 Дж/(моль.К)], Mn3Si, Mn5Si3.
М. взаимод. с водой при комнатной т-ре очень медленно, при нагр. - с умеренной скоростью. Реагирует с разб. соляной и азотной к-тами и с горячей H2SO4 с образованием солей Mn2+ . Из р-ров солей Mn2+ (см. Марганца карбонат. Марганца нитрат. Марганца сульфат) при рН 8,7 осаждается плохо растворимый в воде Mn(ОН)2 - слабое основание. Еще более слабые основные св-ва проявляет нерастворимый в воде гидроксид Mn(III). Известны неустойчивые соли ортомарганцоватистой Н4MnО4 и марганцоватистой Н3MnО4 к-т. наиб. важны соли марганцоватой к-ты Н2MnО4 - манганаты и марганцовой к-ты НMnО4 - перманганаты (см. Манганаты).
Получение. М. получают методами металлотермии - карбо-, силико- или алюминотермич. восстановлением рудных концентратов, а также выщелачиванием руд H2SO4 с послед. электролитич. восстановлением MnSO4. Предварительно руды М. обогащают, иногда обжигают (для разложения карбонатов), восстанавливают (для перевода в соед. Mn2+) или сплавляют с кварцитом.
Карботермич. восстановлением получают высокоуглеродистый ферромарганец (содержащий 6-8% С), силикотермическим - низкоуглеродистый ферромарганец ( ~ 0,1% С), алюминотермическим - чистый М. Металлич. М. с низким содержанием С и Fe получают также восстановлением концентратов силикомарганцем (содержит более 36% Si).
Hаиб. чистый М. с концентрацией примесей металлов менее 0,1% получают электролизом р-ров MnSO4 (с концентрацией 35-40 г/л) в присут. (NH4)2SO4 (ок. 150 г/л) при рН 8,0-8,5. Для очистки от газовых примесей жидкий М. вакуумируют или перегоняют в вакууме.
Определение. Качественно Mn3+ обнаруживают по красно-фиолетовому окрашиванию, возникающему при добавлении р-ров солей Mn3+ к щелочному р-ру формальдоксима, или по коричневому пятну, появляющемуся на фильтровальной бумаге (смоченной предварительно р-ром 8-гидроксихинолина) после нанесения капли р-ра соли Mn3+ .
Количественно М. определяют спектрофотометрически в виде иона MnО4 (предварительно Mn2+ и Mn3+ окисляют до MnО4 избытком КIO4 в среде HNO3-H3PO4).
Из р-ров Mn2+ м.б. осажден в виде MnS действием (NH4)2S; осадок имеет сначала светло-розовый цвет, к-рый при нагр. переходит в зеленый.
Применение. М. один из основных металлов, используемых
для раскисления, десульфурации и легирования сталей (более 90% производимого М. применяют в металлургии). Для удаления из стали О и S М. вводят в виде высокоуглеродистого ферромарганца (8-9 кг на 1 т стали), для легирования стали-в виде средне- и малоуглеродистого ферромарганца. М. - компонент сплавов цветных металлов, сплавов с Аl и Mg. М. придает стали, Аl и Mg прочность, твердость, улучшает способность к закаливанию, устойчивость к коррозии. М. применяют также для получения сплавов на его основе и для создания защитных антикоррозионных покрытий на металлах.
В капиталистич. странах в произ-ве соед. М. ежегодно используется ок. 800 тыс. т марганцевых руд (о применении соед. М. см. соответствующие статьи), в произ-ве марганцевоцинковых ферритов, применяемых для изготовления трансформаторов и др. радиотехн. устройств, для получения окрашенного стекла и цветных глазурей, для фосфатирования стальных изделий - ок. 10 тыс. т/год.
Произ-во марганцевого концентрата (тыс. т, в пересчете на металл): в Австралии 1750, Бразилии 2000, Габоне 2200, Гане 290, Индии 1400, ЮАР 3200 (1985); в СССР 9876 (1983).
М. необходим для жизнедеятельности организмов. Недостаток М. у растений вызывает хлороз (недостаток хлорофилла). Нек-рые почвы бедны М. и нуждаются в марганцевых удобрениях. Недостаток М. в организме человека (суточная доза составляет ок. 4 мг) также может вызывать заболевания. В то же время соед. М. токсичны, поражают центр. нервную систему, вдыхание пыли из соед. М. в течение 1-3 лет может привести к хронич. отравлениям; ПДК (в пересчете на М.) для М. как аэрозоля конденсации 0,03 мг/м , как аэрозоля дезинтеграции 0,2 мг/м3, при одновременном воздействии М. и фтора 0,15 мг/м3.
М. открыл К. Шееле и выделил в чистом виде Ю. Ган в 1774.
===
Исп. литература для статьи «МАРГАНЕЦ»: Позин М. Е., Технология минеральных солей, 4 изд., ч. 1, Л., 1974; Электрохимия марганца, т. 1-8, Тб., 1957-1979; Kemmitt R. D. W., Peacock R. D., The chemistry of manganese, technetium and rhenium, Oxf, 1975 (Pergamon texts in inorganic chemistry, v. 22). Э. Г. Раков.
Страница «МАРГАНЕЦ» подготовлена по материалам химической энциклопедии.
|

