КУЛОНОМEТРИЯ, электрохим метод исследования и анализа, основанный на измерении кол-ва электричества (Q), прошедшего через электролизер при электрохим. окислении или восстановлении в-ва на рабочем электроде. Согласно объединенному Фарадея закону, масса электрохимически превращенного в-ва (Р) в г связана с Q в Кл соотношением: Р=QM/Fn, где М-молекулярная или атомная масса в-ва, п- число электронов, вовлеченных в электрохим. превращение одной молекулы (атома) в-ва (М/n - электрохим. эквивалент в-ва), F - постоянная Фарадея. К.-единственный физ.-хим. метод анализа, в к-ром не требуются стандартные образцы.
Различают прямую К. и кулонометрич. титрование (К. т.). В первом случае определяют электрохимически активное в-во, во втором случае - независимо от электрохим. активности определяемого в-ва в испытуемый р-р вводят электрохимически
активный вспомогат. реагент, продукт электрохим. превращения к-рого (кулонометрич. титрант) с большой скоростью и количественно химически взаимодействует с определяемым в-вом. Оба варианта К. можно проводить при постоянном потенциале Е рабочего электрода (потенциостатич. режим) или при постоянном токе электролиза Iэ (гальваностатич. режим). наиб. часто используются прямая К. при постоянном Е и К.т. при постоянном Iэ.
Для кулонометрич. анализа необходимо соблюдение след. условий: электрохим. превращение в-ва должно протекать со 100%-ным выходом по току (h), т.е. должны отсутствовать побочные электрохим. и хим. процессы; нужны надежные способы определения кол-ва электричества и установления момента завершения электрохим. или хим. р-ции.
В прямой К. 100%-ный выход по току обеспечивается, если значение Е поддерживать постоянным в области предельного диффузионного тока Iпp на вольтамперограмме определяемого в-ва (см. Вольтамперометрия). При этом в анализируемом р-ре должны отсутствовать посторонние в-ва, способные электрохимически превращ. в тех же условиях. Кол-во электричества определяют обычно с помощью электронных интеграторов тока. Иногда пользуются менее точными приборами - кулонометрами разл. типа, а также планометрическим и расчетными методами. В последних двух случаях завершением электролиза считают момент, когда Iэ падает до значения фонового тока Iф, поэтому кол-во электричества, необходимое для завершения электродной р-ции, равно разности Qоб—Qф, где Qоб - общее кол-во электричества, Qф - кол-во электричества, измеренное в тех же условиях за то же время электролиза tэ, но в отсутствие определяемого в-ва. Если электрохим. р-ция первого порядка, то It=I0е-Kt=I0.10-Kt, К=2,30ЗК'=SD/Vd, где It и I0 - ток электролиза соответственно в момент времени т и при t=0, S - площадь пов-сти электрода, D - коэф. диффузии электрохимически активного в-ва, d - толщина диффузионного слоя, V - объем р-ра в ячейке. Продолжительность электролиза не зависит от начальной концентрации в-ва, но заметно сокращается с увеличением соотношения S/V и при интенсивном перемешивании р-ра (уменьшении 6). Можно считать электролиз завершенным, когда Iэ станет равен 0,1 I0 или 0,01 I0 (в зависимости от требуемой точности анализа). В планометрич. способе для установления Q измеряют площадь под кривой It - t, т.к. 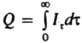 . В расчетном способе решают последнее ур-ние, подставляя в него выражение для It. После интегрирования получают Q=I0/К=I0/2,303K'. Для нахождения I0 и К' выражение для It логарифмируют и по нескольким (5-7) точкам строят прямую lgIt-t, тангенс угла наклона к-рой равен К', а точка пересечения с осью ординат соответствует lgI0, т.е. для определения Q нет необходимости проводить электролиз до конца и измерять I0, значение к-рого плохо воспроизводится. В др. расчетном способе Q вычисляют по ф-ле Q=[Q22-Q1Q3]/(2Q2-Q1-Q3), где Q1, Q2 и Q3 - кол-ва электричества в моменты времени t1, t2 и t3 соотв., причем (t2-t1)~(t3-t2). Прямая К. при постоянном Iэ осуществима, только когда определяемое в-во находится или предварительно выделено в виде твердой фазы на рабочем электроде. Анодное (катодное) растворение при постоянном Iэ и измерение tэ в момент резкого изменения Е позволяет рассчитать Q=Iэtэ. Преимущество прямой К. перед К.т. - высокая селективность.
Однако наиб. распространенный метод кулонометрич. анализа - К. т. в гальваностатич. режиме, т. к. он отличается простотой аппаратурного оформления и более высокой точностью. Для нахождения оптим. условий проведения эксперимента вычисляют значения выхода по току по ф-ле h=(iэ-iф).100/iэ, где iэ и iф - плотности тока электролиза (т. е. отношения Iэ/S) соотв. в присут. вспомогат. реагента и без него при одних и тех же значениях Е. Варьируя т-ру, рН среды, концентрации электрохимически активного в-ва и разл. фоновых электролитов, а также значения iэ, строят
графики h=f(iэ) и находят область iэ, при к-рой h~100%. Существуют и другие, реже используемые способы расчета оптим. значения iэ. Обычно вычисляют также эффективность титрования Qэ.100/Qt (%), где Q, и (Qt - соотв. эксперим. и тeорeтич. значения кол-ва электричества при К. т. известной массы определяемого в-ва.
Если определяемое в-во А электрохимически активно, его предельный ток должен быть меньше тока электролиза и значительно меньше предельного тока (I'пр) вспомогат. реагента С. При этом в электролизере происходят электрохим. р-ции: A6ne:В и Сbme:D, а также хим. р-ция (окисление-восстановление, комплексообраювание, осаждение или кислотно-основное взаимод.) mA+nD:mB+nС или mА+nD:AmDn. При электролизе концентрация реагента С остается постоянной (если он регенерируется) или меняется незначительно, т.к. его концентрация в р-ре на 3-4 порядка превышает концентрацию определяемого в-ва. Т. обр., значение I'пр практически постоянно. Поэтому в-во С называют электрохим. буфером, поддерживающим постоянное значение Е. В К. т. время электролиза мало, т. к. содержание А в электролизере уменьшается одновременно вследствие электрохим. и хим. р-ций. Если А неэлектроактивно, то для выбора оптим. значения iэ предварительно определяют зависимость выхода по току в-ва D от iэ, как описано выше. Конец хим. р-ции устанавливают с помощью цветных индикаторов или физ. - хим. методами. Среди последних наиб. удобны потенциометры и амперометрия с одним или двумя поляризованными электродами (см. Амперометричeское титрование). Кол-во электричества рассчитывают по ф-ле Q=Iэtэ. Кулонометрич. титрант получают из растворимых солей, твердых электрохимически активных материалов (Ag, Hg), амальгам, электродов второго рода и из воды (при определении к-т и оснований) в присут. инертных электролитов, создающих необходимую электропроводность р-ра. Преимущества К. т. перед обычными титримeтрич. методами: нет необходимости стандартизовать р-ры титранта; титрант прибавляется очень малыми порциями (практически непрерывно); р-р не разбавляется; можно генерировать электрохимически неактивные титранты, напр. комплексон III, а также малоустойчивые сильные окислители и восстановители, в частности Mn(III), Pb(IV), Сr(П), V(II), Ti(III).
Установки для кулонометрич. анализа (рис. 1,2) состоят из потенциостата или гальваностата, регистрирующего потенциометра или интегратора тока, электролизера и индикац. системы (в случае использования физ.-хим. методов для . В расчетном способе решают последнее ур-ние, подставляя в него выражение для It. После интегрирования получают Q=I0/К=I0/2,303K'. Для нахождения I0 и К' выражение для It логарифмируют и по нескольким (5-7) точкам строят прямую lgIt-t, тангенс угла наклона к-рой равен К', а точка пересечения с осью ординат соответствует lgI0, т.е. для определения Q нет необходимости проводить электролиз до конца и измерять I0, значение к-рого плохо воспроизводится. В др. расчетном способе Q вычисляют по ф-ле Q=[Q22-Q1Q3]/(2Q2-Q1-Q3), где Q1, Q2 и Q3 - кол-ва электричества в моменты времени t1, t2 и t3 соотв., причем (t2-t1)~(t3-t2). Прямая К. при постоянном Iэ осуществима, только когда определяемое в-во находится или предварительно выделено в виде твердой фазы на рабочем электроде. Анодное (катодное) растворение при постоянном Iэ и измерение tэ в момент резкого изменения Е позволяет рассчитать Q=Iэtэ. Преимущество прямой К. перед К.т. - высокая селективность.
Однако наиб. распространенный метод кулонометрич. анализа - К. т. в гальваностатич. режиме, т. к. он отличается простотой аппаратурного оформления и более высокой точностью. Для нахождения оптим. условий проведения эксперимента вычисляют значения выхода по току по ф-ле h=(iэ-iф).100/iэ, где iэ и iф - плотности тока электролиза (т. е. отношения Iэ/S) соотв. в присут. вспомогат. реагента и без него при одних и тех же значениях Е. Варьируя т-ру, рН среды, концентрации электрохимически активного в-ва и разл. фоновых электролитов, а также значения iэ, строят
графики h=f(iэ) и находят область iэ, при к-рой h~100%. Существуют и другие, реже используемые способы расчета оптим. значения iэ. Обычно вычисляют также эффективность титрования Qэ.100/Qt (%), где Q, и (Qt - соотв. эксперим. и тeорeтич. значения кол-ва электричества при К. т. известной массы определяемого в-ва.
Если определяемое в-во А электрохимически активно, его предельный ток должен быть меньше тока электролиза и значительно меньше предельного тока (I'пр) вспомогат. реагента С. При этом в электролизере происходят электрохим. р-ции: A6ne:В и Сbme:D, а также хим. р-ция (окисление-восстановление, комплексообраювание, осаждение или кислотно-основное взаимод.) mA+nD:mB+nС или mА+nD:AmDn. При электролизе концентрация реагента С остается постоянной (если он регенерируется) или меняется незначительно, т.к. его концентрация в р-ре на 3-4 порядка превышает концентрацию определяемого в-ва. Т. обр., значение I'пр практически постоянно. Поэтому в-во С называют электрохим. буфером, поддерживающим постоянное значение Е. В К. т. время электролиза мало, т. к. содержание А в электролизере уменьшается одновременно вследствие электрохим. и хим. р-ций. Если А неэлектроактивно, то для выбора оптим. значения iэ предварительно определяют зависимость выхода по току в-ва D от iэ, как описано выше. Конец хим. р-ции устанавливают с помощью цветных индикаторов или физ. - хим. методами. Среди последних наиб. удобны потенциометры и амперометрия с одним или двумя поляризованными электродами (см. Амперометричeское титрование). Кол-во электричества рассчитывают по ф-ле Q=Iэtэ. Кулонометрич. титрант получают из растворимых солей, твердых электрохимически активных материалов (Ag, Hg), амальгам, электродов второго рода и из воды (при определении к-т и оснований) в присут. инертных электролитов, создающих необходимую электропроводность р-ра. Преимущества К. т. перед обычными титримeтрич. методами: нет необходимости стандартизовать р-ры титранта; титрант прибавляется очень малыми порциями (практически непрерывно); р-р не разбавляется; можно генерировать электрохимически неактивные титранты, напр. комплексон III, а также малоустойчивые сильные окислители и восстановители, в частности Mn(III), Pb(IV), Сr(П), V(II), Ti(III).
Установки для кулонометрич. анализа (рис. 1,2) состоят из потенциостата или гальваностата, регистрирующего потенциометра или интегратора тока, электролизера и индикац. системы (в случае использования физ.-хим. методов для
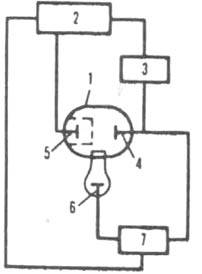
Рис. 1. Схема установки для прямой кулономeтрии при постоянном E: 1 электролизер; 2 источник постоянного токa с регулируемым напряжением: 3 прибор для определения кол-ва злектричества: 4 рабочий электрод; 5 вспомогательный электрод; 6 электрод сравнения, относительно к-рого контролируют потенциал рабочего электрода: 7 устройство, измеряющее разность потенциалов.
установления конца хим. р-ции в К. т.). Приборы для К. легко автоматизируются. Электролизеры (см., напр., на рис. 2) представляют собой, как правило, стеклянные сосуды, катодные и анодные камеры в к-рых разделены диафрагмой (напр., из пористого стекла). В качестве рабочих и вспомогательных (замыкающих цепь электролиза) электродов используют благородные металлы (Pt, Au), электроды второго рода и, реже, углеродные материалы (графит, стеклоуглерод и др.). Р-р, в к-рый погружен рабочий электрод, перемешивают обычно магн. мешалкой; при необходимости эксперимент проводят в атмосфере инертного газа.
К. применяют для определения как следовых, так и весьма больший кол-в в-в с высокой точностью. Погрешность прямой К. в потенциостатич. режиме обычно 0,5-1%, а К.т. в гальваностатич. режиме - 0,1-0,3%. Особенно точен дифференциальный вариант К. В этом случае в цепь последовательно включают два идентичных электролизера, в один из к-рых вносят стандартное в-во в известном кол-ве, эквивалентном кол-ву электричества Q1, к-рое на величину Q2 меньше кол-ва электричества, необходимого для завершения электрохим. или хим. р-ции определяемого в-ва во втором электролизере. Электролиз проводят в одинаковых условиях при строгом контроле значений Е и Iэ. Все погрешности сказываются только на кол-ве электричества Q2, к-рое обычно
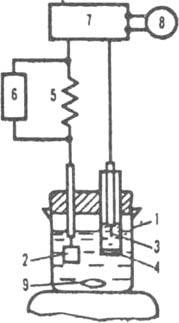
Рис. 2. Схема установки для кулонометрич. титрования: 1 электролизер: 2 рабочий электрод (электрод генерации): 3 - вспомогательный электрод: 4 пористое стекло: 5 прецизионное сопротивление: 6 устройство, измеряющее разность потенциалов: 7 источник постоянного тока: 8 хронометр: 9 магнитная мешалка.
составляет 2-5% Q1. Содержание определяемого в-ва соответствует сумме Q1+Q2. Чувствительность кулонометрич. методов определяется в осн. способами установления момента завершения электрохим. или хим. р-ции и составляет 10-8-10-9 моль/л. Использование неводных и водно-орг. сред расширяет область потенциалов, в к-рой протекают электрохим. и хим. р-ции, и таким образом увеличивает круг в-в, анализируемых кулонометрически.
К. применяют для анализа мн. неорг. (практически все металлы, галогены, S и др.) и орг. в-в (ароматич. амины, нитро- и нитрозоcоединения, фенолы, азокрасители, алифатич. амиды и др.); определения воды в орг. в-вах; установления толщины и анализа металлич. покрытий; изучения процессов коррозии; исследования кинетики и механизма хим. р-ций (в т.ч. каталитических); определения констант равновесия р-ций; установления числа электронов, участвующих в электрохим. и хим. взаимодействиях, и т.д. Кулонометрич. детекторы широко используются в проточно-инжeкционном анализе и хроматографии (см. Детекторы хроматографические).
===
Исп. литература для статьи «КУЛОНОМEТРИЯ»: Зозуля А. Н.. Кулонометрический анализ, 2 изд., Л.. 1968: Агасян П. К., Хамракулов Т. К.. Кулонометрическкй метод анализа. М., 1984.
П. К, Агасян. Л. Б. Оганесян.
Страница «КУЛОНОМEТРИЯ» подготовлена по материалам химической энциклопедии.
|

