| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КРЕМНИЙ (Silicium) Si, химический элемент IV гр. периодич. системы, ат. н. 14, ат. м. 28,0855. Состоит из трех стабильных изотопов 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). Поперечное сечение захвата тепловых нейтронов 1,3.10-29 м2. Конфигурация внеш. электронной оболочки 3s23p2; степень окисления +4 (наиб. устойчива), +3, +2 и +1; энергии ионизации при последоват. переходе от Si° к Si4+ соотв. 8,1517, 16,342, 33,46 и 45,13 эВ; сродство к электрону 1,22 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,133, ионный радиус Si4+ (в скобках указаны координац. числа) 0,040 нм (4), 0,054 нм (6), ковалентный - 0,1175 нм.
К.-второй после кислорода по распространенности в земной коре элемент (27,6% по массе). В своб. состоянии в природе не встречается, находится преим. в виде SiO2 (см. Кремния диоксид) или силикатов. В виде SiO2 К. входят в состав растит. и животных организмов (напр., скелетные части).
Свойства. Компактный К.- в-во серебристо-серого цвета с металлич. блеском. Кристаллич. решетка устойчивой модификации кубич. гранецентрированная типа алмаза, а=0,54307 нм, пространств. группа Fd3m, z=4. При высоких давлениях существуют др. полиморфные модификации: при 20 ГПа-К. I с тетрагон. решеткой (а=0,4686 нм, с=0,2585 нм), выше 20 ГПа-К. II с кубич. (а=0,644 нм) и К. III с гексагон. (а=0,380 нм, с=0,628 нм). При кристаллизации из газовой фазы на пов-стях с т-рой ниже 600 °С образуется аморфный К. Для кристаллич. Si т. пл. 1415 °С (плавится с уменьшением объема на 9%), т. кип. 3249 °С; плотн. 2,33 г/см3; C0p 20,16 Дж/(моль.К); DH0пл 49,9 кДж/моль, DH0исп 445,2 кДж/моль; S298 18,9 Дж/(моль.К); давление пара 0,046 Па (1415 °С); температурный коэф. линейного расширения 3,72.10-6К-1 (291-1273 К) и -.0,6.10-6 К-1 (84 К); теплопроводность 95,5 Вт/(м.К); р 2,4-107 Ом м (25 °С); т-ра Дебая 645 К; e 12; диамагнетик, магн. восприимчивость — 3,9.10-6.
При обычных условиях К. хрупок, выше 800 °С становится пластичным. К. прозрачен для И К излучения при длинах волн l>1 мкм; коэф. преломления 3,565 (l=1,05 мкм), 3,443 (l=2,6 мкм), 3,45 (l= 2-10 мкм); отражат. способность 0,3 (l>1,5 мкм). К. - полупроводник; ширина запрещенной зоны 1,21 эВ при т-ре ок. 0 К и 1,09 эВ при 300 К; концентрация носителей тока в К. с собственной проводимостью 1,5-1016 м-3 (300 К); температурная зависимость подвижности электронов и дырок [м2/(В.с)] определяется соотв. выражениями: mn=4,0.105Т-2,6 (300[T[400 К) и mр = 2,5.104T-2,3 (150[T[400 К); при 300 К mn=
0,145 м2/(В.с), mp=0,048 м2/(В.с), коэф. диффузии электронов 3,5.10-3 м2/с, дырок - 1,3.10-3 м2/с.
Электрофиз. св-ва К. зависят от природы и концентрации присутствующих примесей и структурных дефектов. Для получения монокристаллов К. с дырочной проводимостью используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с электронной проводимостью - Р, As, Sb (донорные примеси). Примеси Аu, Сu, Fe, Mn, V и нек-рые др. существенно снижают время жизни носителей тока в монокристаллах К. Макс, р-римость примесей в К. наблюдается при 1200-1300 °С и м. б. грубо оценена по значению коэф. распределения между твердым К. и его расплавом. Акцепторные примеси в К. имеют большие значения коэф. диффузии, чем донорные. Ряд примесей (Li, Сu, Аu) диффундирует по междоузлиям кристаллич. решетки с очень высокими скоростями. Для определения содержания примесей в К. высокой чистоты используют прецизионные методы: спектральный и активационный анализ, метод ЭПР и др.
Производят монокристаллы К. без дислокаций диаметром до 0,156 м. Осн. дефекты в таких монокристаллах К.-скопления собств. междоузельных атомов, вакансий и атомов остаточных примесей. Для определения природы и содержания структурных дефектов в К. применяют избират. травление (в осн. смесью к-т: HF, HNO3 и СН3СООН), рентгеновский и др. методы.
Электрич. св-ва К. могут сильно изменяться при термич. обработке. Так, нагревание монокристаллов, содержащих кислород, до 400-500 °С приводит к увеличению электронной проводимости, а при послед. нагревании до 1 1000-1200 °С этот эффект пропадает. Обычно термич. обработка приводит к существ. снижению времени жизни носителей тока. Для предотвращения вредного действия термич. обработки используют предварит. обработку пов-сти монокристаллов К. спец. орг. реактивами, отжиг в хлорсодержащей атмосфере, грубую шлифовку, бомбардировку ионами и др. методы.
При низких т-рах К. химически инертен, при нагр. его реакц. способность резко возрастает. Особенно активен расплавленный К. Координац. число атома К. 4, иногда 6 (напр., во фторосиликатах, содержащих анион [SiF6]2-). Соед., где К. формально двухвалентен, по-видимому, содержат связь Si—Si и, как правило, полимерны. Благодаря образующейся на пов-сти защитной оксидной пленке К. устойчив на воздухе даже при повыш. т-рах. Окисляется О2 выше 400°С до SiO2 (см. также Кремния оксид). Стоек к действию к-т, взаимод. только со смесью HNO3 и фтористоводородной к-ты. Хорошо реагирует с р-рами щелочей с выделением Н2 и образованием силикатов. Взаимод. с F2 уже при комнатной т-ре, с остальными галогенами - при 300-500 °С с образованием галогенидов SiX4 или Sin,X2n+2 (см. Кремния иодиды, Кремния фториды, Кремния хлориды). С парами S при 600 °С дает дисульфид SiS2, к-рый выше 600 °С переходит в моносульфид SiS; аналогичные, хотя и менее прочные соед., образует с Те и Se.
С Н2 К. непосредственно не реагирует, поэтому силаны SinH2n+2 получают косвенным путем - разложением силицидов. Аморфный К. обладает способностью растворять значит. кол-ва разл. газов, прежде всего Н2. При этом образуется твердый р-р (до 47 ат. % водорода), называемый l-Si:H, к-рый обладает полупроводниковыми св-вами.
С азотом выше 1000 °С К. образует кремния нитрид Si3N4, с фосфором - фосфид SiP, с мышьяком - арсениды SiAs2 и SiAs, с углеродом -кремния карбид SiC, с бором - термически и химически стойкие бориды SiB3, SiB6 и SiB12. С большинством металлов дает тугоплавкие высокотвердые силициды. Об орг. производных К. см. Кремнийорганические полимеры, Кремнийорганические соединения, Кремнийэлементоорганические соединения.
Получение. К. производят восстановлением расплава SiO2 углеродом в дуговых печах при 1800°С. Чистота техн. продукта после спец. кислотной обработки ок. 99,9%. Очень небольшие кол-ва К. получают электролизом р-ров Na2SiF6 или K2SiF6 в расплавах.
Для получения К. высокой чистоты техн. продукт хлорируют до SiQ4 или SiHCl3. Эти хлориды подвергают глубокой очистке ректификацией, сорбцией, путем частичного гидролиза и спец. термич. обработок, а затем восстанавливают при 1200-1300 °С высокочистым Н2 в установках из нержавеющей стали или непрозрачного кварцевого стекла. Восстанавливаемый К. осаждают на прутки из К. высокой чистоты. Др. пром. метод получения К. высокой чистоты основан на разложении ок. 1000 °С SiH4, предварительно очищенного ректификацией. SiH4 синтезируют взаимод. Mg2Si с соляной или уксусной к-той, диспропор-ционированием SiH(OC2H5)3 в присут. Na или р-цией LiAlH4 с SiQ4 в эфире. Перечисл. методами получают К. с суммарным содержанием остаточных примесей 10-7-10-8 % по массе.
Монокристаллы К. выращивают по методу Чохральского или бестигельной зонной плавкой (см. Монокристаллов выращивание). В первом случае процесс проводят в кварцевых тиглях в вакууме или инертной атмосфере с применением нагревателей из особо чистого графита. Масса исходной загрузки 60-100 кг, диаметр получаемых монокристаллов до 0,15 м, длина до 1,5-2,0 м. Зонную плавку проводят в глубоком вакууме или атмосфере особо чистого Н2; этим способом получают наиб. чистые монокристаллы. Диаметр монокристаллов до 0,125 м, длина до 1,5 м. Легируют монокристаллы непосредственно в процессе выращивания. Для получения однородных монокристаллов, легированных фосфором, их часто облучают медленными нейтронами [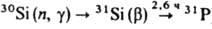 ].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С. ].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С.
Определение. Качественно К. обнаруживают по образованию (преим. в кислых средах) коллоидных р-ров гидратированного SiO2, окрашенных солей кремнемолибденовой к-ты H4[Si(Mo3O10)4]. Макроколичества К. (не менее 0,1% по массе) определяют гравиметрически, титриметрически и фотометрически. Гравиметрич. методы основаны на способности К. образовывать гель H2SiO3, к-рый затем высушивают и взвешивают. При титриметрич. определении К. переводят в H2SiF6, титруют щелочью или осаждают в виде малорастворимых солей H4[Si(Mo3O10)4] и определяют Мо
в осадке. Большинство фотометрич. методов основано на переводе бесцв. H2SiO3 в желтую кремнемолибденовую к-ту, к-рую и определяют.
Микроколичества К. определяют след. методами: эмиссионным спектральным (до 1-10-5 %), нейтронно-активационным (до 1.10-6 %), масс - спектрометрич. (до 1.10-б %), атомно-абсорбционным с непламенной атомизацией (до 1.10-4 %). Применение. К.-один из осн. полупроводниковых материалов в электронике. Приборы на его основе могут работать при т-рах до 200 °С. Его используют для изготовления интегральных схем, диодов, транзисторов, солнечных батарей, фотоприемников, детекторов частиц в ядерной физике и др., а также линз в приборах ИК техники. В металлургии К. применяют как восстановитель (для получения силико-марганца, силикоалюминия и др.), при произ-ве ферросилиция, для раскисления - удаления растворенного в расплавленных металлах кислорода. К.-компонент электротехн. и др. сталей, чугунов, бронз, силуминов. К. и его соед. используют для получения кремнийорг. производных и силицидов ряда металлов. a-Si:H применяют для изготовления солнечных батарей, полевых транзисторов и др.
Мировое произ-во К. (без СССР) для нужд полупроводникового приборостроения составляет ок. 5000 т/год поликристаллич. К. и ок. 2200 т/год монокристаллов (1984).
К.-биогенный элемент. Он необходим для нормального роста и развития человека, животных, растений и микроорганизмов: является структурным элементом соединит. ткани, связывая макромолекулы мукополисахаридов и коллагена, играет существ. роль в метаболизме мн. растений и морских организмов, влияет на скорость минерализации и препятствует возникновению атеросклероза. Соед. К. токсичны. Вдыхание мельчайших частиц пыли SiO2 и др. соед. К. (напр., асбеста) вызывает опасную профессиональную болезнь - силикоз.
К. получен впервые Ж. Л. Гей-Люссаком и Л. Ж. Тенаром в 1811.
===
Исп. литература для статьи «КРЕМНИЙ»: Реньян В. Р.. Технология полупроводникового кремния, пер. с англ., М., 1969; Медведев С. А., Введение в технологию полупроводниковых материалов, М., 1970; Мильвидский М. Г., Полупроводниковые материалы в современной электронике, М., 1986; Нашельский А. Я.. Технология полупроводниковых материалов, М., 1987. М. Г. Мильвидский.
Страница «КРЕМНИЙ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

