| СОДЕРЖАНИЕ: |
НАУКА и ТЕХНОЛОГИИ |
ТЕНДЕНЦИИ РЫНКА |
ЭКОЛОГИЯ |
СОТРУДНИЧЕСТВО |
СОБЫТИЯ ОТРАСЛИ |
|
|
|
|
СЛОВАРЬ ТЕРМИНОВ
|
|
|
|
|
Алфавитный указатель:
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
|
КОБАЛЬТА ГАЛОГЕНИДЫ. Св-ва К. г. приведены в таблице. Кобальта дифторид CoF2 - розовые кристаллы с тетрагон, решеткой (а = 0,46951 нм, с=0,3179нм, z=2, пространств, группа Р4/тпт); DH°пл 44,8 кДж/моль, Д//° 201 кДж/моль (2012 К); aG°обр - 620,7 кДж/моль; S° 81,96 Дж/(моль.К). Раств. в воде (14,5 г/л при 25 °С). Образует ди- и тетрагидраты, из р-ров HF осаждается в виде CoF2.5HF.6H2O. Получают взаимод. СоО или СоСО3 с газообразным HF при нагр. термич. разложением NH4CoF3, осаждением из водных р-ров солей Со2+ при действии фтористоводородной к-ты с послед. дегидратацией. Дифторид - промежут. продукт при синтезе CoF3, комплексных фторидов Со(III) и Co(IV). Его применяют в произ-ве катодов в хим. источниках тока, как компонент лазерных материалов, катализатор в произ-ве фторуглеводородов.
Кобальта трифторид CoF3 - коричневые, светло-коричневые или зеленовато-коричневые кристаллы с ромбоэдрич. решеткой (а = 0,5279 нм, а = 56,97 °, z = 2, пространств, группа 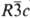 ). Возгоняется без разложения. Гидролизуется водой и ее парами, не раств. в этаноле, эфире, бензоле и др. орг. р-рителях. Электролитич. окислением суспензии CoF2 в 40%-ном р-ре HF получен голубой CoF3.3,5 H2O. При 300-400 °С при взаимод. CoF3 с орг. в-вами замещаются атомы Н и Сl на F; CoF3 фторирует ненасыщ. соединения. Получают взаимод. Со или CoF2 с F2 или ClF3 при 200-300 °С. CoF3 - реагент и катализатор при синтезе фторуглеводородов. ). Возгоняется без разложения. Гидролизуется водой и ее парами, не раств. в этаноле, эфире, бензоле и др. орг. р-рителях. Электролитич. окислением суспензии CoF2 в 40%-ном р-ре HF получен голубой CoF3.3,5 H2O. При 300-400 °С при взаимод. CoF3 с орг. в-вами замещаются атомы Н и Сl на F; CoF3 фторирует ненасыщ. соединения. Получают взаимод. Со или CoF2 с F2 или ClF3 при 200-300 °С. CoF3 - реагент и катализатор при синтезе фторуглеводородов.
СВОЙСТВА ГАЛОГЕНИДОВ КОБАЛЬТА
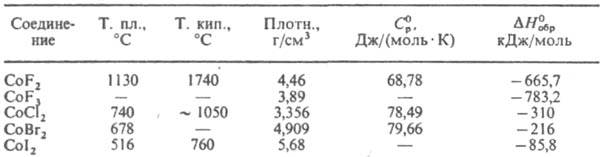
Кобальта дихлорид СоСl2 - голубые гигроскопичные кристаллы. Существует в двух полиморфных модификациях, т-ра перехода 680 °С; DH0пл, 38 кДж/моль, DH0исп 14,5 кДж/моль; DG0обр - 267 кДж/моль; S0298 109,6 Дж/(моль.К). Раств. в воде (51,3 г в 100 г при 20 °С), давая р-ры розового цвета. Образует сине-фиолетовый моногидрат (устойчив на воздухе до 110°С, т. пл. 335 °С, с разл.), фиолетовый дигидрат (устойчив до 90 °С, т. пл. 206 °С, с разл.), темно-красный тетрагидрат и красно-коричневый гексагидрат (т. пл. 51,2 °С, с разл.). Раств. в метаноле и этаноле с образованием синих р-ров. Получают взаимод. Со с Сl2, взаимод. Со, СоО, Со(ОН)2 или солей Со2+ с соляной к-той с послед. дегидратацией в вакууме при 150°С или обработкой SOCl2. Дихлорид и его гидраты - протравы при крашении тканей, микродобавки в корм скоту, компоненты р-ров для нанесения покрытий Со на металлы; дихлорид используют также для получения катализаторов, в индикаторах влажности.
Кобальта дибромид СоВr2 - зеленые гигроскопичные кристаллы. Существует в двух полиморфных модификациях, т-ра перехода 375 °С, DH0 перехода 1,67 кДж/моль; DН0исп 205 кДж/моль (951 К). Раств. в воде (199,1 г в 100 г при 60 °С), этаноле, эфире и др. полярных р-рителях. Образует моногидрат (на воздухе устойчив до 130 °С, т. пл. 238 °С, с разл.), дигидрат (устойчив до 100 °С, т. пл. 160 °С, с разл.), пурпурный тетрагидрат (т. пл. 62,0 °С, с разл.) и красно-фиолетовый гексагидрат (т. пл. 43,6 °С, с разл.). Получают
взаимод. Со с Вr2 при нагревании. Применяют, дибромид для получения катализаторов, в индикаторах влажности.
Кобальта дииодид CoI2 - коричнево-красные гигроскопичные кристаллы с гексагон. решеткой. Известна также желтая модификация, получаемая при перегонке в вакууме. Раств. в воде (237,7 г в 100 г при О °С). Образует гидраты с 9, 6, 4 и 2 молекулами воды. Получают взаимод. Со с HI при 400-500 °С. Применяют в индикаторах влажности.
В р-ре получены также СоСl3, СоВr3, СоI3, в виде комплексных соед.-фториды и хлориды Со(III) и Co(IV).
Лит.: Nichplls D., The chemistry of iron, cobalt and nickel, Oxf, 1975 (Pergamon texts in inorganic chemistry, v. 24). Э. Г. Раков.
===
Исп. литература для статьи «КОБАЛЬТА ГАЛОГЕНИДЫ»: нет данных
Страница «КОБАЛЬТА ГАЛОГЕНИДЫ» подготовлена по материалам химической энциклопедии.
|
|
|
|

|
|
Куплю
19.04.2011 Белорусские рубли в Москве Москва 18.04.2011 Индустриальные масла: И-8А, ИГНЕ-68, ИГНЕ-32, ИС-20, ИГС-68,И-5А, И-40А, И-50А, ИЛС-5, ИЛС-10, ИЛС-220(Мо), ИГП, ИТД Москва 04.04.2011 Куплю Биг-Бэги, МКР на переработку. Москва |
Продам
19.04.2011 Продаем скипидар Нижний Новгород 19.04.2011 Продаем растворители Нижний Новгород 19.04.2011 Продаем бочки новые и б/у. Нижний Новгород |
|
|

