|
ГАЛОГЕНЗАМЕЩЕННЫЕ
УГЛЕВОДОРОДОВ, орг. соед., в молекулах к-рых содержатся атомы
галогенов, связанные с углеводородными радикалами (алифатич., ароматич.
и алициклическими). В зависимости от характера радикала, у к-рого находится
атом галогена, в алифатич. ряду различают первичные, вторичные и третичные
Г. у., напр.: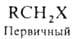 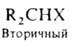
(здесь
и ниже Х-атом галогена).
По
номенклатуре ИЮПАК назв. Г. у. производят от назв. углеводородов с указанием
места замещения галогеном: СН3СНС1СН3-2-хлорпропан,
СН2С1СН2СНВrСН3-3-бром-1 -хлорбутан, СС13Вr
- бромтрихл орметан, С6Н5СF3-трифторметилбензол,
С6Н3С13-1,2,3-, 1,2,4- или 1,3,5-трихлорбензол,
C6H4FCl-o-, м- или n-фторхлорбензол.
Назв.
моно- и нек-рых дигалогензамещенных углеводородов алифатич. и алициклич.
рядов производят также от назв. соответствую.щих углеводородных радикалов
с прибавлением слов хлористый (хлорид), бромистый (бромид) и т.д., напр.
хлористый изопропил СН3СНС1СН3, метилиодид СН31,
фтористый изопропилиден CH3CF2CH3, циклогексилхлорид
С6НПС1, бензилхлорид С6Н5СН2С1.
Для нек-рых Г. у. приняты тривиальные названия, напр. хлороформ СНС13,
хлоропрен СН2=СС1СН=СН2, гексахлоран С6Н6С16.
Полностью галогенированные углеводороды (все атомы Н замещены атомами галогена)
наз. пергалогенированными (напр., перхлорированными, перфорированными).
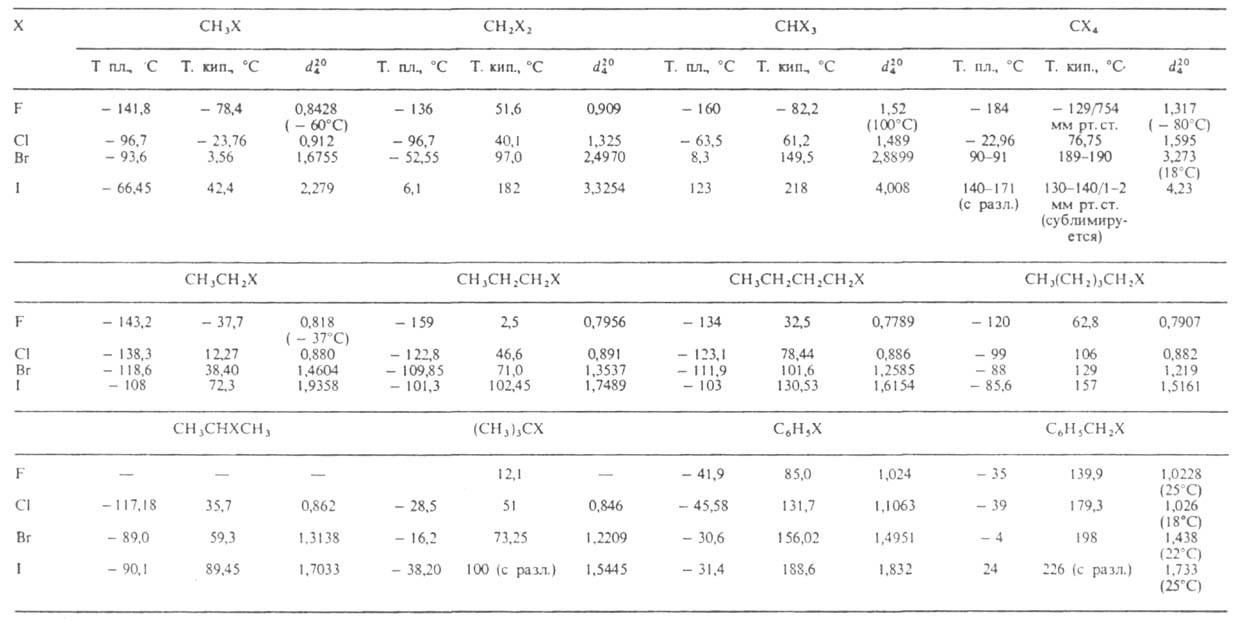
Свойства.
Физ.
свойства нек-рых Г. у. приведены в таблице. Т-ры кипения и плотность алифатич.
Г. у. с одинаковым числом атомов С уменьшаются в ряду: первичные > > вторичные
> третичные. С увеличением числа атомов галогена в молекуле т-ры кипения
и плотность возрастают. Г. у., содержащие при одном атоме углерода 2 или
3 атома галогена, всегда имеют более низкие т-ры плавления и кипения, плотность,
чем аналогичные им соед. с тем же числом атомов галогена, но при разл.
углеродных атомах. Г. у. изостроения также имеют более низкие т-ры кипения
и плотность, чем Г. у. нормального строения с тем же числом атомов С и
галогена.
В чистом
состоянии все Г. у. бесцветны. Йодистые соед. быстро приобретают красную
или коричневую окраску из-за незначит. разложения под действием света.
Низшие Г. у. обладают сладковатым запахом. В воде почти не раств., со многими
орг. р-рителями (эфиром, спиртом и др.) смешиваются в любых соотношениях.
Обычно
иод подвижнее брома, а бром-хлора, что обусловлено величиной энергии (кДж/моль)
связей С—X: 443 (С—F), 328 (С—С1), 276 (С—Вr), 240 (С—I). Фториды по своим
св-вам заметно отличаются от остальных Г. у. (см. Фторорганические соединения).
В
пром-сти чаще применяют хлориды вследствие большего распространения хлора
в природе и более легкого и экономически целесообразного получения хлорпроизводных
углеводородов.
Одна
из наиб. характерных р-ций Г. у.-нуклеоф. замещение. Так, при взаимод.
с Н2О и слабыми р-рами щелочей они образуют спирты, с алкоголятами
- простые эфиры, с солями карбоновых к-т-сложные эфиры, с NaCN - нитрилы
и т.д. Атом галогена у углерода при двойной связи (в т. ч. и в ароматич.
Г. у.), напр. в винилхлориде, хлорбензоле и подобных им соединениях, связан
очень прочно и с трудом вступает в р-ции нуклеоф. замещения. В отличие
от этого, атом галогена у группы СН2, соседней с двойной связью
или бензольным кольцом (аллильное или бензильное положение), очень подвижен
и легко поддается замещению. Г.у. взаимод. с NH3 в спиртовом
р-ре или газовой фазе, образуя в зависимости от условий первичные, вторичные
и третичные амины, а также четвертичные аммониевые соли. При гидролизе
дигалогенидов типа RCHX2 или RCX2R' образуются соотв.
альдегиды или кетоны, тригалогенидов КСХ3-карбоновые к-ты.
СВОЙСТВА НЕКОТОРЫХ ГАЛОГЕНЗАМЕЩЕННЫХ
УГЛЕВОДОРОДОВ
Под
действием конц. р-ров щелочей от Г. у. отщепляется НХ и образуются олефины,
напр. СН3СН2С1 -> СН2=СН2 +
НС1; в случае моно-, ди- и тригалогенметанов-карбены, напр. СНС13
-> :СС12 + HC1 (см. Дегидрогалогенирование). Углеводороды
с атомами галогена у соседних атомов С под действием Zn в спиртовой среде
подвергаются дегалогенированию с образованием ненасыщ. соед., напр.:
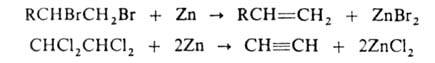
Если
галогены расположены у удаленных друг от друга атомов С, часто образуются
циклич. соед., напр.:
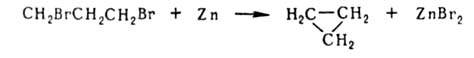
Алифатич.
моногалогениды вступают с Na в Вюрца реакцию; аналогичным образом
Na взаимод. с арилгалогенидами, превращающимися в производные бифенила
(Вюрца -Фиттига р-ция).
При
действии Mg или Li на Г. у. в эфире или ТГФ образуются магнийорг. (Гриньяра
реактивы) или литийорг. соединения (напр., CH3MgI, C4H9Li,
C6H5Li), широко применяемые в орг. синтезе.
В молекулах
Г. у. можно заместить на водород один, два и т.д. или все атомы галогена
с образованием соответствующего углеводорода или с разрывом связи С—С.
При гидрировании ненасыщ. Г. у. часто происходят одновременно присоединение
Н2 и замещение галогена, напр.:
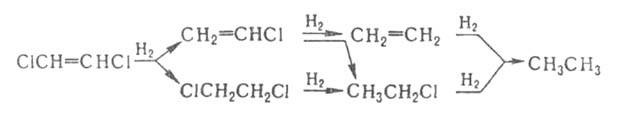
Насыщенные
алифатич., а также ароматич. Г. у., особенно монопроизводные, достаточно
устойчивы к действию окислителей, и только в жестких условиях (облучение
УФ-светом, повыш. т-ра и др.) они окисляются до НХ, Х2, Н2О,
СО и СО2; хлориды - также до СОС12. Ненасыщ. Г. у.
легко реагируют с О2, О3, HNO3, КМnО4,
орг. надкислотами с образованием разл. кислородсодержащих соед.; напр.,
действием надкислот получают эпоксидные соед. или гли-коли. Промежут. продукты
при окислении О2 - неустойчивые пероксиды.
Алифатич.,
алициклич. и арилалифатич. (особенно бензильного типа) Г.у. используют
для алкилирования, в т.ч. и ароматич. углеводородов, в присут. к-т Льюиса,
напр. А1С13, FeCl3, BF3 (см. Фридеяя-Крафтса
реакция):
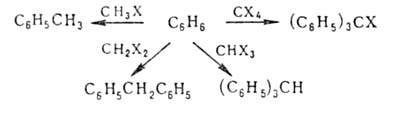
Г. у.
в условиях р-ции Фриделя - Крафтса легко присоединяются к олефинам, а также
к ненасыщ. Г.у.:
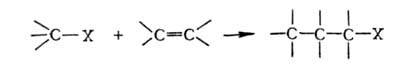 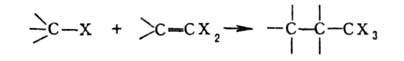
Хлор-
и бромуглеводороды способны участвовать в р-циях тело мери зации:
СС14 + nСН2=СН2
-> СС13—[СН2—СН2]n—С1
Разнообразная
реакц. способность Г. у. на примере СН3С1 показана на схеме
(R-алифатич., алициклич. или ароматич. радикал):
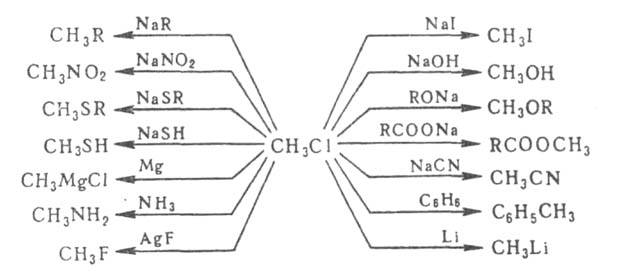
Из приведенных
на схеме р-ций для ароматич. Г. у. характерны р-ции с Mg, Li и NaR; р-ции
с NaNO2, AgF, Nal и RCOONa вообще не протекают, остальные осуществляются
только в жестких условиях.
Получение
и применение. Способы получения зависят от типа углеводорода, природы
галогена или галогенирующего агента. наиб. распространенный метод получения
Г. у.-галогенирование. При гидрогалогенировании по кратным связям
углеводородов легче всего присоединяется HI, затем - НВr, труднее - НС1
и HF. В пром-сти этим способом синтезируют такие важные продукты, как винилхлорид,
винилфторид, этилхлорид, метилхлороформ (см. Трихлорэтаны)и
др. Подробно см. в ст. Гидрогалогенирование. Метод обмена галогенов
в Г. у. применяют преим. для получения фтористых и йодистых соединений
(см. Финкелыитапна реакция). Ароматич. Г.у. получают заменой аминогруппы,
связанной с ядром, на галоген (см. Зандмейера реакция, Гаттермана синтез
и
Шимана
реакция).
Нек-рые
полигалогенсоединения можно получить присоединением СНС13 или
СС14 к хлоролефинам в присут. А1С13, напр.: СС12=СС12
+ СНС13 -> СНС12СС12СС13. В
присут. пероксидов к СС14 присоединяется этилен; при этом в
результате цепной р-ции образуются в-ва общей ф-лы С1—[СН2СН2]n—СС13
(см. Теломеризация).
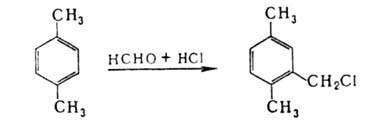
Хлорметилированием
ароматич. соединений, напр. СН2О и соляной к-той в присут. ZnCl2,
получают бензилхлориды:
Г. у.
находят широкое и разнообразное практич. применение. Многие из них-р-рители
для обезжиривания металлич. поверхностей, хим. чистки, в различных хим.
процессах (напр., метиленхлорид, тетрахлорэтилен, трихлорэтилен, трихлорэтаны,
1,1,2-трифтор-1,2,2-трихлорэтан,
дихлорбензолы).
Фторхлорзамещенные
метаны и этаны (напр., CC13F, CC12F2,
CHC1F2)-хладагенты для холодильных машин и наполнители для аэрозольных
упаковок (см. Хладоны). Ряд непредельных Г. у. (винилхлорид,
винилиденхлорид, хлоропрен, тетрафторэтилен)-
мономеры для получения
полимеров (напр., поливинилхлорида, политетрафторэтилена, хлоропренового
каучука, разл. сополимеров). Многие Г. у. обладают сильным физиол. действием.
Так, этилхлорид, йодоформ, хлороформ-обезболивающие средства в медицине.
Нек-рые Г.у. (гексахлорциклогексан, гексахлор-бутадиен, смесь дихлорпропанов
и дихлорпропенов, называемая ДД, металлилхлорид, инсектицид ДДТ, гептахлор,
дилор и др.) обладают сильными пестицидными св-вами. Гексахлор-n-ксилол
- эффективное лечебное ср-во для борьбы с глистными заболеваниями печени
с.-х. животных. Г.у., содержащие бром, - наиб. эффективные антипирены.
Поскольку Г.у. легко вступают в разл. р-ции, их широко используют как исходные
соед. для получения промышленно важных продуктов, напр.: метилхлорид и
этилхлорид - в произ-ве тетраметил- и тетраэтилсвинца, кремнийорг. соед.,
метил- и этилцеллюлозы; аллилхлорид - в произ-ве эпи-хлоргидрина и глицерина;
хлорбензол-в произ-ве фенола; дихлорэтан-этилендиамина, и т.д.
Для
качеств. определения Г.у., как и для всех галогенсодержащих соед., применяется
т. наз. Бейлъштейна проба, количеств. анализ галогенов в орг. соед.
связан с отщеплением галогена с послед. определением галогенид-иона обычными
методами. Р-ция осуществляется в мягких условиях, напр. действием Na в
спирте (по Степанову), или в жестких при полной минерализации анализируемого
в-ва (по Кариусу, в бомбе Парра и т.д.).
===
Исп. литература для статьи «ГАЛОГЕНЗАМЕЩЕННЫЕ»:
Houbcn-Wcyl,
Methoden dcr Organischcn Chemic, 4 Aufl, Bd 5, Tl 3, Stuttg., 1962; Bd
5, Tl 4, Stuttg 1960; Методы элсментоорганической химии. Хлор. Алифатические
соединения, под общ. ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1973;
Kirk-Othmer encyclopedia, 3 ed., v. 2, N.Y., 1978, p. 245-71; v. 5, N.Y.,
1979, p. 668-848. Ю. А. Трегер.
Страница «ГАЛОГЕНЗАМЕЩЕННЫЕ» подготовлена по материалам химической энциклопедии.
|

